
题目列表(包括答案和解析)
 某学生在实验室测定一未知浓度的稀盐酸,已知在25ml氢氧化钠标准溶液中逐滴加入0.2mol/L醋酸溶液的PH变化曲线如图所示:
某学生在实验室测定一未知浓度的稀盐酸,已知在25ml氢氧化钠标准溶液中逐滴加入0.2mol/L醋酸溶液的PH变化曲线如图所示:| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 19.00 | 23.00 | 23.02 |
(12分)某学生在实验室测定一未知浓度的稀盐酸,已知在25ml氢氧化钠标准溶液中逐滴加入0.2mol/L醋酸溶液的PH变化曲线如图所示:
(1)该氢氧化钠溶液的物质的量浓度为 mol.L—1
(2)在B点,a 12.5ml(填“>”、“<”或“=” )。
(3)配制100 mL NaOH标准溶液所需仪器除托盘天平、玻璃棒、胶头滴管外,还需要
(4)用 量取20.00 mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用NaOH标准溶液进行滴定。为了减小实验误差,该同学一共进行了三次实验,假设每次所取稀盐酸体积均为20.00 mL,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 19.00 | 23.00 | 23.02 |
该盐酸的浓度约为___________________(保留两位有效数字)。
滴定达到终点的标志是
(12分)某学生在实验室测定一未知浓度的稀盐酸,已知在25ml氢氧化钠标准溶液中逐滴加入0.2mol/L醋酸溶液的PH变化曲线如图所示: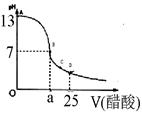
(1)该氢氧化钠溶液的物质的量浓度为 mol.L—1
(2)在B点,a 12.5ml(填“>”、“<”或“="”" )。
(3)配制100 mL NaOH标准溶液所需仪器除托盘天平、玻璃棒、胶头滴管外,还需要
(4)用 量取20.00 mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用NaOH标准溶液进行滴定。为了减小实验误差,该同学一共进行了三次实验,假设每次所取稀盐酸体积均为20.00 mL,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 19.00 | 23.00 | 23.02 |
(12分)某学生在实验室测定一未知浓度的稀盐酸,已知在25ml氢氧化钠标准溶液中逐滴加入0.2mol/L醋酸溶液的PH变化曲线如图所示:
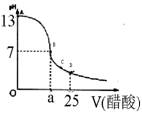
(1)该氢氧化钠溶液的物质的量浓度为 mol.L—1
(2)在B点,a 12.5ml(填“>”、“<”或“=” )。
(3)配制100 mL NaOH标准溶液所需仪器除托盘天平、玻璃棒、胶头滴管外,还需要
(4)用 量取20.00 mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用NaOH标准溶液进行滴定。为了减小实验误差,该同学一共进行了三次实验,假设每次所取稀盐酸体积均为20.00 mL,三次实验结果记录如下:
|
实验次数 |
第一次 |
第二次 |
第三次 |
|
消耗NaOH溶液体积/mL |
19.00 |
23.00 |
23.02 |
该盐酸的浓度约为___________________ (保留两位有效数字)。
滴定达到终点的标志是
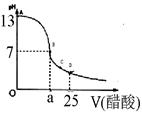
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 19.00 | 23.00 | 23.02 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com