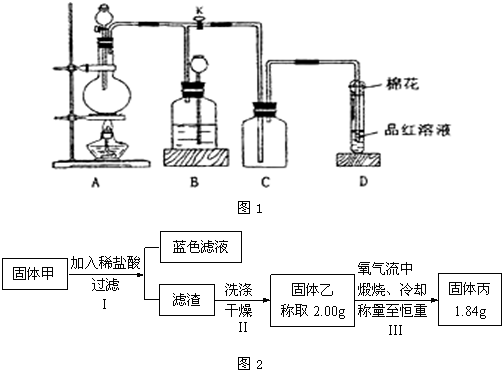
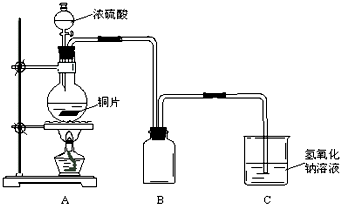
某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置先进行了有关实验:
(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请在图上把导管补充完整.
(2)实验中他们取6.4g 铜片和12mL 18mol?L
-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余.
①写出铜跟浓硫酸反应的化学方程式:
Cu+2H
2SO
4(浓)
CuSO
4+SO
2↑+2H
2O
Cu+2H
2SO
4(浓)
CuSO
4+SO
2↑+2H
2O
;
②为什么有一定量的余酸但未能使铜片完全溶解,你认为原因是
随着反应进行,硫酸被消耗,产物有水生成,所以浓硫酸变成稀硫酸,反应会停止
随着反应进行,硫酸被消耗,产物有水生成,所以浓硫酸变成稀硫酸,反应会停止
;
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是:
AD
AD
(填写编号).
A.铁粉 B.氯化钡溶液 C.银粉 D.碳酸氢钠溶液
(3)为定量测定余酸的物质的量浓度,甲学生进行了如下设计学生设计的方案是:在反应后的溶液中加蒸馏水稀释至1000mL,取20mL与锥形瓶中,滴入2~3滴甲基橙指示剂,用标准氢氧化钠溶液进行滴定(已知氢氧化铜开始沉淀的pH约为5),通过测出消耗氢氧化钠溶液的体积来求余酸的物质的量浓度.假定反应前后烧瓶中溶液的体积不变,你认为他设计的实验方案能否求得余酸的物质的量浓度
不能
不能
(填“能”或“不能”),其理由是
虽然甲基橙变色范围:pH为3.1~4.4,氢氧化铜开始沉淀时的pH为5,在指示剂变色范围之外,即中和酸时,铜离子不会消耗OH-,但是甲基橙由红色变成橙色、黄色时,铜离子溶液呈蓝色,对观察指示终点颜色有干扰
虽然甲基橙变色范围:pH为3.1~4.4,氢氧化铜开始沉淀时的pH为5,在指示剂变色范围之外,即中和酸时,铜离子不会消耗OH-,但是甲基橙由红色变成橙色、黄色时,铜离子溶液呈蓝色,对观察指示终点颜色有干扰
.
(4)现已确认,SO
2和NOx的排放是造成酸沉降的两大罪魁祸首.汽车排放的尾气中含有未燃烧充分的CH、以及N
2、CO
2、NO、CO等.有人设计利用反应2NO+2CO

N
2+2CO
2 将有害的污染物转化为可参与大气循环的N
2和CO
2.
在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间/h |
0 |
1 |
2 |
3 |
4 |
5 |
| c(NO)/mol?L-1 |
1.00×10-3 |
4.5×10-4 |
2.5×10-4 |
1.5×10-4 |
1.00×10-4 |
1.00×10-4 |
| c(CO)/mol?L-1 |
3.6×10-3 |
3.05×10-3 |
2.85×10-3 |
2.75×10-3 |
2.70×10-3 |
2.70×10-3 |
在上述条件下反应能够自发进行,则反应的△H
<
<
0(“>”、“<”、“=”).前2h内的平均反应速率v(N
2)=
1.875×10-4mol?L-1?h-1
1.875×10-4mol?L-1?h-1
,在该温度下,反应的平衡常数K=
5000
5000
.据此你认为将该反应从理论转化为现实的最重要的研究方向是
寻找高效的催化剂
寻找高效的催化剂
.


 N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.
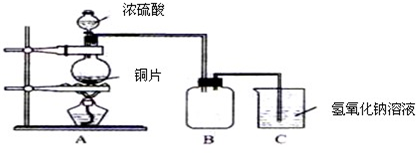
N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.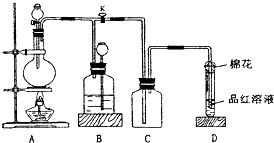 某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用图所示装置进行有关实验.请回答:
某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用图所示装置进行有关实验.请回答: