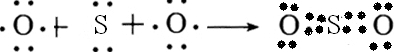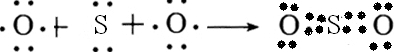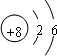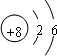有A、B、C、D、E五种元素,其中A、B、C属于同一周期,且原子序数B>C,A原子最外层p能级的电子数等于次外层的电子总数,B元素可分别与A、C、D、E生成常见的RB
2型化合物,并知在DB
2和EB
2中,D与B的质量比为7:8,E与B的质量比为1:1.根据以上条件,回答下列问题:
(1)推断五种元素分别是(用元素名称回答):D
硅
硅
,E
硫
硫
.
(2)指出C元素在元素周期表中的位置
第二周期第ⅤA族
第二周期第ⅤA族
.E元素的最高价氧化物的分子构型为
平面三角形
平面三角形
.
(3)沸点DB
2>
>
EB
2(填“>”、“<”或“=”等于),理由
SiO2是原子晶体,SO2是分子晶体,故沸点SiO2>SO2
SiO2是原子晶体,SO2是分子晶体,故沸点SiO2>SO2
(4)写出与EB
3分子互为等电子体并含A、B、C任意两种元素的微粒
NO3-
NO3-
(填1种)
(5)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,下列是一些键的键能:SiCl
4(g)+2H
2(g) 高温 Si(s)+4HCl(g) 通过计算该反应是
吸
吸
热(填“吸”或
“放”)
236
236
kJ/mol
| 化学键 |
Si-O |
Si-Cl |
H-H |
H-Cl |
Si-Si |
Si-C |
| 键能/kJ?mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |