
题目列表(包括答案和解析)


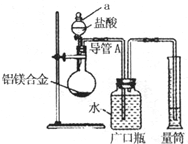 含镁3%~5%的铝镁合金是轮船制造、化工生产、机械制造等行业的重要材料.现有一块质量为m g的铝镁合金,欲测定其中镁的质量分数,几位同学设计了不同的实验方案.
含镁3%~5%的铝镁合金是轮船制造、化工生产、机械制造等行业的重要材料.现有一块质量为m g的铝镁合金,欲测定其中镁的质量分数,几位同学设计了不同的实验方案.| 过量盐酸 |
| 过量NaOH溶液 |
| 过量盐酸 |
| 过量NaOH溶液 |
| 3W2 |
| 5m |
| 3W2 |
| 5m |
| () |

| ||
| ||




湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com