[化学-物质结构与性质]
第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物.
(1)①H、C、N、O四种元素的电负性由小到大的顺序为
.
②下列叙述不正确的是
.(填字母)
A.因为HCHO与水分子间能形成氢键,所以CH
2O易溶于水
B.HCHO和CO
2分子中的中心原子均采用sp
2杂化
C.C
6H
6分子中含有6个σ键和1个大π键,C
2H
2是非极性分子
D.CO
2晶体的熔点、沸点都比二氧化硅晶体的低
③氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式
.
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物.
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是
.
②六氰合亚铁离子[Fe(CN)
6]
4-中不存在
.
a、共价键 b、非极性键 c、配位键 d、σ键 e、π键
并写出一种与CN
_互为等电子体的单质分子式
.
③三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂.据此判断三氯化铁的晶体类型为
.
(3)①Ti的在周期表中位置
.根据元素原子的外电子排布的特征,可将元素周期表分成五个区域,其中Ti属于
区.
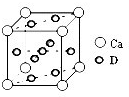
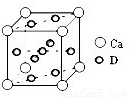
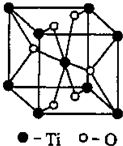
②Ti的一种氧化物X,其晶胞结构如上图所示,则X的化学式为
.工业上利用X和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐),同时生成一种气体氧化物,制备M的化学反应方程式是
.

 [化学-物质结构与性质]
[化学-物质结构与性质] ,则COCl2分子内含有_____个π键,C原子的杂化方式为____。
,则COCl2分子内含有_____个π键,C原子的杂化方式为____。