
题目列表(包括答案和解析)

NaCl晶体结构示意图
图1-1-1
(1)将固体NaCl细粒干燥后,准确称取m g NaCl固体并转移到定容仪器A中;
(2)用滴定管向A仪器中加苯,不断振荡,继续加苯至A仪器的刻度,计算出NaCl固体的体积V cm3。
请回答下列问题:
①步骤(1)中A仪器最好使用__________ (填序号)。
A.量筒 B.烧杯 C.容量瓶 D.试管
②步骤(2)中用酸式滴定管还是用碱式滴定管__________,理由是____________________。
③能否用水代替苯__________,理由是___________________________________________。
④已知NaCl晶体中,靠得最近的Na+与Cl-间的平均距离为a cm(如图1-1-1),用上述测定方法测得的阿伏加德罗常数NA的表达式为_________________________________________。
(3)另一种方法是电解法,方法是:用铂电极电解CuCl2溶液时,当电流为I,通电时间为t(单位:分钟)时,阴极增加的质量为m,在阳极收集到气体体积(标准状况)为V。又知1个电子的电荷量为Q,铜的摩尔质量为M,则计算阿伏加德罗常数NA的算式为( )
A.It/QV B.32It/mQ C.672It/QV D.30MIt/mQ
(4)由实验得知,用电解法将电解液中的金属离子还原为金属单质时,电极所通过的电量Q正比于金属的物质的量n和金属离子的化合价a的乘积,其比例系数F是一恒量,称为法拉第常数。它与金属的种类无关。
用电镀法在半径为R的铜球表面均匀镀上很薄的银层,在电解槽中铜球作__________极,另一电极材料是__________。若电流为I,通电时间为t,银的相对原子质量为A,金属银的密度为ρ,求镀层的厚度d(用本题中的符号表示)。



铜、铁、钒都是日常生活中常见的金属,具有广泛用途。请回答:
(1)在元素周期表中,铜元素位于____区,其基态原子的电子排布式为???????? 。
(2)Cu2O的熔点比Cu2S高,原因为??????????????????????? 。
(3)Fe(CO)5是一种常见的配合物,可代替四乙基铅作为汽油的抗爆震剂。
①写出CO的一种常见等电子体分子的结构式____;两者相比较沸点高的为?????? (填分子式)。
②Fe(CO)5在一定条件下发生反应:Fe(CO)5(s)=Fe(s)+5CO(g),已知:反应过程中,断裂的化学键只有配位键,由此判断该反应所形成的化学键类型为???????? 。
(4)已知AlCl3·NH3和AlCl4—中均有配位键。AlCl3·NH3中,提供空轨道的原于是____;在AlCl4中Al原子的杂化轨道类型为??????????? 。
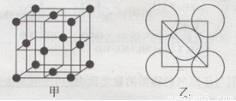
(5)金属铝的晶胞结构如图甲所示,原子之间相对位置关系的平面图如图乙所示。则晶体铝中原子的堆积方式为____。已知:铝原子半径为d cm,摩尔质量为M g·mol-1,阿伏加德罗常数的值为NA,则晶体铝的密度ρ=??????????? 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com