
题目列表(包括答案和解析)
11.汤姆生用来测定电子的比荷(电子的电荷量与质量之比)的实验装置如图所示。真空管内的阴极K发出的电子(不计初速、重力和电子间的相互作用)经加速电压加速后,穿过![]() 中心的小孔沿中心轴O1O的方向进入到两块水平正对放置的平行金属极板P和
中心的小孔沿中心轴O1O的方向进入到两块水平正对放置的平行金属极板P和![]() 间的区域。当极板间不加偏转电压时,电子束打在荧光屏的中心O点处,形成了一个亮点;加上偏转电压U后,亮点偏离到
间的区域。当极板间不加偏转电压时,电子束打在荧光屏的中心O点处,形成了一个亮点;加上偏转电压U后,亮点偏离到![]() 点,
点,![]() 与O点的竖直间距为d,水平间距可以忽略不计。此时,在P点和
与O点的竖直间距为d,水平间距可以忽略不计。此时,在P点和![]() 间的区域,再加上一个方向垂直于纸面向里的匀强磁场。调节磁场的强弱,当磁感应强度的大小为B时,亮点重新回到O点。已知极板水平方向的长度为L1,极板间距为b,极板右端到荧光屏的距离为L2(如图所示)。(1)求打在荧光屏O点的电子速度的大小。(2)推导出电子比荷的表达式。
间的区域,再加上一个方向垂直于纸面向里的匀强磁场。调节磁场的强弱,当磁感应强度的大小为B时,亮点重新回到O点。已知极板水平方向的长度为L1,极板间距为b,极板右端到荧光屏的距离为L2(如图所示)。(1)求打在荧光屏O点的电子速度的大小。(2)推导出电子比荷的表达式。

金属钛生产方法的新动向――电解法:首先将二氧化钛粉末用浇注或压力成形,烧结后作阴极,以石墨为阳极,以CaCl2为熔盐,所加电压为2.8V~3.2V。电解一定时间后,阴极由白色变为灰色,在扫描电子显微镜下观察,有海绵状钛生成,阳极析出气体为氧气。下列说法错误的是:
A.阴极的电极反应式为:TiO2+4e-=Ti+ 202-
B.电解过程中使用2.8V~3.2V电压的主要原因可能是:在此电压下,熔融的氯化钙不能电解
C.电解时Ca2+向阴极移动
D.电解时每转移4mol电子,阳极有2 molO2生成
4、回旋加速器是用来加速带电粒子的装置,它的核心部分是两个D型金属盒,如图6所示,盒正中间开有一个窄缝,在两个D形盒之间加交流电压,于是在缝隙中形成交变电场,由于电屏蔽作用,在D型盒内部电场很弱。D型盒装在真空容器中,整个装置放在巨大电磁铁的两极之间,磁场方向垂直于D型盒的底面。
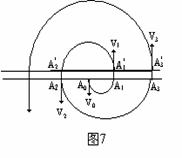 回旋加速器的工作原理如图7所示。放在A0处的粒子源发出一个带正电的粒子,它以某一速率V0垂直进入匀强磁场,在磁场中做匀速圆周运动。经过半个周期,当它沿着圆弧A0A1到达A1时,在
回旋加速器的工作原理如图7所示。放在A0处的粒子源发出一个带正电的粒子,它以某一速率V0垂直进入匀强磁场,在磁场中做匀速圆周运动。经过半个周期,当它沿着圆弧A0A1到达A1时,在![]() 处加一个向上的电场,使这个带电粒子在
处加一个向上的电场,使这个带电粒子在![]() 受到一次电场加速,速率由V0增加到V1。然后粒子以速率V1在磁场中做匀速圆周运动。我们知道,粒子的轨道半径跟它的速率成正比,因而粒子沿着半径增大了的圆周运动。又经过半个周期,当它沿着半圆弧
受到一次电场加速,速率由V0增加到V1。然后粒子以速率V1在磁场中做匀速圆周运动。我们知道,粒子的轨道半径跟它的速率成正比,因而粒子沿着半径增大了的圆周运动。又经过半个周期,当它沿着半圆弧![]() 到达
到达![]() 时,在
时,在![]() 处加一个向下电场,使粒子又一次受到电场的加速,速率增加到V2。如此继续下去,每当粒子运动到窄缝处时都使它受到电场的加速,粒子将沿着图示螺线
处加一个向下电场,使粒子又一次受到电场的加速,速率增加到V2。如此继续下去,每当粒子运动到窄缝处时都使它受到电场的加速,粒子将沿着图示螺线![]() ……回旋下去,速率将一步一步地增大。
……回旋下去,速率将一步一步地增大。
已知回旋加速器的D型盒半径为R=60cm。两盒间距1cm,用它加速质子时可使质子获得4MeV的能量,加速电压为U=2×104V。求(1)该加速器中偏转磁场的磁感应强度;(2)质子在D型盒中运动的时间t;(3)整个过程中,质子在运动的总时间![]() 。
。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com