
题目列表(包括答案和解析)
| a | |||||||||||||||||
| f | y | h | i | ||||||||||||||
| b | e | j | |||||||||||||||
| c | d | g | l | ||||||||||||||




| a | |||||||||||||||||
| f | y | h | i | ||||||||||||||
| b | e | j | |||||||||||||||
| c | d | d | g | l | |||||||||||||



| a | |||||||||||||||||
| f | y | h | i | ||||||||||||||
| b | e | j | |||||||||||||||
| c | d | g | l | ||||||||||||||




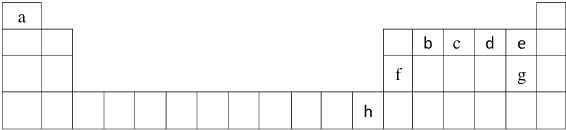
(13分)下表为元素周期表的一部分,a、b、c…为部分元素。回答下列问题:
| a |
|
| |||||||||||||||
|
|
|
|
| f | y[ | h | i |
| |||||||||
|
| b |
| e |
|
|
| j |
| |||||||||
| c |
|
|
|
|
|
| d |
| d |
| g |
| l |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
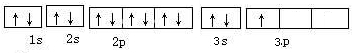
(1)请写出上述元素g的核外电子排布式 ;
(2)请比较b、e两种元素的第一电离能 (写元素符号),其原因是
(3)试比较i、j两种元素的气态氢化物的稳定性 (写化学式)
(4)f2a4分子的结构式是 ,该分子中存在的σ键与π键的个数比为
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com