
题目列表(包括答案和解析)
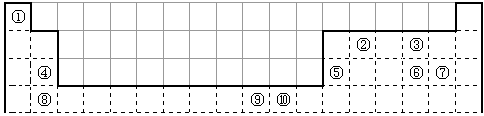
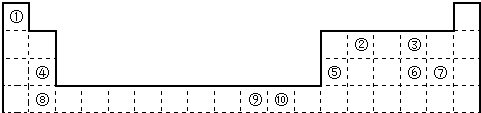
下表为长式周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)表中属于d区的元素是 (填编号)。
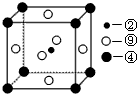
 (2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如右图(图中②、④、⑨分别位于晶胞的
(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如右图(图中②、④、⑨分别位于晶胞的
体心、顶点、面心),则该化合物的化学式为
(用对应的元素符号表示)。
(3)元素②的一种氢化物是重要的化工原料,
常把该氢化物的产量作为衡量石油化工发展水
平的标志。有关该氢化物分子的说法正确的是 。
A.分子中含有氢键 B.属于非极性分子
C.含有4个σ键和1个π键 D.该氢化物分子中,②原子采用sp2杂化
(4)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为 ;该元素与元素①形成的分子X构形为 ;X在①与③形成的分子Y中的溶解度很大,其主要原因是 。
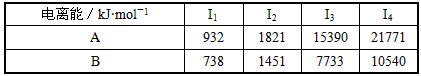
(5)A、B均为短周期金属元素。依据下表数据,写出B原子的电子排布式:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
(6)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般而言,为d0或d10排布时,无颜色;为d1~d9排布时,有颜色,如[Co(H2O)6]2+显粉红色。据此判断,[Mn(H2O)6]2+ 颜色(填“无”或“有”)。
(12分)下表为长式周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)表中属于d区的元素是 (填编号)。
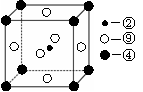
 (2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如右图(图中②、④、⑨分别位于晶胞的
(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如右图(图中②、④、⑨分别位于晶胞的
体心、顶点、面心),则该化合物的化学式为
(用对应的元素符号表示)。
(3)元素②的一种氢化物是重要的化工原料,
常把该氢化物的产量作为衡量石油化工发展水
平的标志。有关该氢化物分子的说法正确的是 。
A.分子中含有氢键 B.属于非极性分子
C.含有4个σ键和1个π键 D.该氢化物分子中,②原子采用sp2杂化
(4)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为 ;该元素与元素①形成的分子X构形为 ;X在①与③形成的分子Y中的溶解度很大,其主要原因是 。
(5)A、B均为短周期金属元素。依据下表数据,写出B原子的电子排布式:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
(6)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般而言,为d0或d10排布时,无颜色;为d1~d9排布时,有颜色,如[Co(H2O)6]2+显粉红色。据此判断,[Mn(H2O)6]2+ 颜色(填“无”或“有”)。

| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com