
题目列表(包括答案和解析)
C2H2(g)+H2(g)![]() C2H4(g) (1)
C2H4(g) (1)
2CH4(g)![]() 2H2(g)+C2H4(g) (2)
2H2(g)+C2H4(g) (2)
据此判断以下3个热化学方程式中
C(s)+2H2(g)![]() CH4(g) DH 1=-Q1 ①
CH4(g) DH 1=-Q1 ①
2C(s)+H2(g)![]() C2H2(g) DH 2=-2Q2 ②
C2H2(g) DH 2=-2Q2 ②
2C(s)+2H2(g)![]() C2H4(g) DH 3=-2Q3 ③
C2H4(g) DH 3=-2Q3 ③
热量Q1、Q2、Q3由大到小的正确顺序是( )
A.Q1、Q2、Q3 B.Q1、Q3、Q2
C.Q3、Q2、Q1 D.Q2、Q1、Q3
某课外实验小组利用稀硫酸与金属铁反应探究影响化学反应速率的因素,得到如下实验数据:
![]()
| 实验
| 铁的
| 铁的
| c/(H2SO4)
| V(H2SO4)
| 溶液温度/℃ | 金属消失
| |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 铁片 | 0.7 | 50 | 20 | 36 | 250 |
| 2 | 0.10 | 铁片 | 0.8 | 50 | 20 | 35 | 200 |
| 3 | 0.10 | 铁粉 | 0.8 | 50 | 20 | 36 | 25 |
| 4 | 0.10 | 铁片 | 1.0 | 50 | 20 | 35 | 125 |
| 5 | 0.10 | 铁片 | 1.0 | 50 | 35 | 50 | 50 |
![]() 分析上述数据,回答下列问题:
分析上述数据,回答下列问题:
![]() (1)实验2和3表明, 对反应速率有影响,影响规律是
(1)实验2和3表明, 对反应速率有影响,影响规律是
![]() ;
;
![]() (2)仅表明反应物浓度对反应速率产生影响的实验有 (填实验序号);
(2)仅表明反应物浓度对反应速率产生影响的实验有 (填实验序号);
![]() (3)本实验中影响反应速率的其他因素还有 ,能体现该影响因素的实验序号是 ;
(3)本实验中影响反应速率的其他因素还有 ,能体现该影响因素的实验序号是 ;
![]() (4)在实验4中滴入几滴硫酸铜溶液,金属消失的时间小于125s。
(4)在实验4中滴入几滴硫酸铜溶液,金属消失的时间小于125s。
![]() 原因是
原因是
![]() ;
;
![]() (5)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,试从反应过程能量的变化角度推测其原因
(5)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,试从反应过程能量的变化角度推测其原因
![]() 。
。
(10分)某课外实验小组利用稀硫酸与金属铁反应探究影响化学反应速率的因素,得到如下实验数据:
![]()
实验
| 铁的
| 铁的
| c/(H2SO4)
| V(H2SO4)
| 溶液温度/℃ | 金属消失
| |
反应前 | 反应后 | ||||||
1 | 0.10 | 铁片 | 0.7 | 50 | 20 | 36 | 250 |
2 | 0.10 | 铁片 | 0.8 | 50 | 20 | 35 | 200 |
3 | 0.10 | 铁粉 | 0.8 | 50 | 20 | 36 | 25 |
4 | 0.10 | 铁片 | 1.0 | 50 | 20 | 35 | 125 |
5 | 0.10 | 铁片 | 1.0 | 50 | 35 | 50 | 50 |
![]() 分析上述数据,回答下列问题:
分析上述数据,回答下列问题:
![]() (1)实验2和3表明, 对反应速率有影响,影响规律是
(1)实验2和3表明, 对反应速率有影响,影响规律是
;
(2)仅表明反应物浓度对反应速率产生影响的实验有 (填实验序号);
(3)本实验中影响反应速率的其他因素还有 ,能体现该影响因素的实验序号是 ;
(4)在实验4中滴入几滴硫酸铜溶液,金属消失的时间小于125s。原因是
(5)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,试从反应过程能量的变化角度推测其原因 。
新华社2009年10月15日报道:全国农村应当在“绿色生态—美丽多彩—低碳节能—循环发展”的理念引导下,更好更快地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设。可见“低碳循环”已经引起了国民的重视,试回答下列问题:
(1)煤的气化和液化可以提高燃料的利用率。
已知25℃,101kPa时:C(s)+![]()

则在25℃,101kPa时:C(s)+H2O(g)=CO(g)+H2(g)△H= 。
(2)高炉炼铁是CO气体的重要用途之一,其基本反应为:
FeO(s)+CO(g) ![]() Fe(s)+CO2(g)△H>0,已知在1100℃时,该反应的化学平衡常数K=0.263。
Fe(s)+CO2(g)△H>0,已知在1100℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K的值 (填“增大”、“减小”或“不变”)
②1100℃时测得高炉中,c(CO2)=0.025mol·L-1,c(CO)=0.1mol·L-1,则在这种情况下,该反应是否处于化学平衡状态? (填“是”或“否”),其判断依据是
。
(3)目前工业上可用CO2来生产燃料甲醇,有关反应为:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)△H=—49.0kJ·mol-1。现向体积为1L的密闭容器中,充入1molCO2和3molH2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
CH3OH(g)+H2O(g)△H=—49.0kJ·mol-1。现向体积为1L的密闭容器中,充入1molCO2和3molH2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
|
①从反应开始到平衡,氢气的平均反应速率v(H2)= ;
②下列措施能使![]() 增大的是 (填符号)。
增大的是 (填符号)。
A.升高温度 B.再充入H2
C.再充入CO2 D.将H2O(g)从体系中分离
E.充入He(g),使体系压强增大
(17分)
![]() 某研究性小组借助A-D的仪器装置完成有关实验
某研究性小组借助A-D的仪器装置完成有关实验
![]()
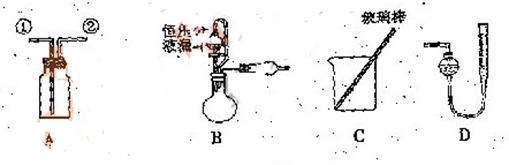
![]() 【实验一】收集NO气体。
【实验一】收集NO气体。
(1) ![]() 用装置A收集NO气体,正确的操作上 (填序号)。
用装置A收集NO气体,正确的操作上 (填序号)。
![]() a.从①口进气,用排水法集气 b.从①口进气,用排气法集气
a.从①口进气,用排水法集气 b.从①口进气,用排气法集气
![]() c.从②口进气,用排水法集气 d..从②口进气,用排气法集气
c.从②口进气,用排水法集气 d..从②口进气,用排气法集气
![]() 【实验二】为了探究镀锌薄铁板上的锌的质量分数
【实验二】为了探究镀锌薄铁板上的锌的质量分数![]() 和镀层厚度,查询得知锌易溶于碱:Zn+2NaOH=Na2ZnO3+H2↑据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1 g。用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验。
和镀层厚度,查询得知锌易溶于碱:Zn+2NaOH=Na2ZnO3+H2↑据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1 g。用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验。
![]() 方案甲:通过测量试样与碱反应生成的氢气体积来实现探究木目标。
方案甲:通过测量试样与碱反应生成的氢气体积来实现探究木目标。
![]() (2)选用B和 (填仪器标号)两个装置进行实验。
(2)选用B和 (填仪器标号)两个装置进行实验。
![]() (3)测得充分反应后生成氢气的体积为VL(标准状况),
(3)测得充分反应后生成氢气的体积为VL(标准状况),![]() = 。
= 。
![]() (4)计算镀层厚度,还需要检索的一个物理量是 。
(4)计算镀层厚度,还需要检索的一个物理量是 。
![]() (5)若装置B中的恒压分液漏斗改为普通分液漏斗,测量结果将(填“偏大”、“偏小”或“无影响”)。
(5)若装置B中的恒压分液漏斗改为普通分液漏斗,测量结果将(填“偏大”、“偏小”或“无影响”)。
![]() 方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器C做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为m2g 。
方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器C做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为m2g 。
![]() (6)
(6)![]() 。
。
![]() 方案丙:通过称量试样与碱反应前后仪器、试样和试剂的总质量(其差值即为H2的质量)实现探究目标。实验同样使用仪器C。
方案丙:通过称量试样与碱反应前后仪器、试样和试剂的总质量(其差值即为H2的质量)实现探究目标。实验同样使用仪器C。
![]() (7)从实验误差角度分析,方案丙 方案乙(填“优于”、“劣于”或“等同于”)。
(7)从实验误差角度分析,方案丙 方案乙(填“优于”、“劣于”或“等同于”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com