
题目列表(包括答案和解析)
| 1 |
| 2 |
| 催化剂 |
(12分)
(1)在250C、101KPa时,1g甲醇完全燃烧生成CO2和液态水时放热22.68kJ,则能表示甲醇燃烧的热化学方程式为:
________________________________________________________________________。
(2)已知:C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)="==" CO2(g); △H=—394kJ·mol—1;
2CO(g)+O2(g)="==" 2CO2(g); △H=—566kJ·mol—1;
2H2(g)+O2(g)="==" 2H2O(g); △H=—484 kJ·mol—1;
①在25℃、101KPa时,1 g甲醇不完全燃烧生成1∶1的CO、CO2和液态水,写出此甲醇燃烧的热化学方程式:
_____________________________________________________________________。
②工业上可由CO和H2合成甲醇。试写出由C(s)与水蒸气在高温条件下反应生成氢气
和一氧化碳的热化学方程式 。
(3)利用甲醇可设计燃料电池。
①如用氢氧化钾溶液做电解质溶液,用多孔石墨做电极,在电极上分别充入甲醇和氧
气。写出负极的电极反应式 。
②下列有关甲醇燃料电池的说法中,错误的是_________
A.甲醇燃料电池的负极发生氧化反应
B.甲醇燃料电池的电子由负极、经外电路流入正极
C.甲醇燃料电池在负极区产生CO
D.甲醇燃 料电池中使用的氢氧化钾浓度保持不变
料电池中使用的氢氧化钾浓度保持不变
(15分)现有A、B、C、D四种原子序数依次递增的短周期元素,E是常见的金属元素。已知A的最外层只有一个电子,B的最外层电子数是次外的三倍,C与A的最外层电子数相同,D与B是同主族元素。化合物甲是由A、B、C三种元素组成,化合物乙B、D、E三种元素组成,甲乙两种溶液混合有蓝色沉淀产生。化合物丙和丁都由B、C、D三种元素组成,且丙的相对分子质量比丁大16。请回答下列问题。
(1)画出C的原子结构示意图 ,指出D在周期表中的位置 。
(2)写出丙和丁的化学式,丙 ,丁 。鉴别丙的阴离子的方法是 。
(3)写出以Mg、Al为电极材料,以甲为电解质溶液所组成的原电池,负极的电极反应式 。
(4)若用石墨为电极,在250C时,电解200mL乙的溶液,当阴极增重6.4g,则反应后溶液的PH= (设反应后溶液的体积仍为200mL);若以铜作电极,电解乙的水溶液,当外电路通过0.2mol电子时,理论上两极质量相差 g。
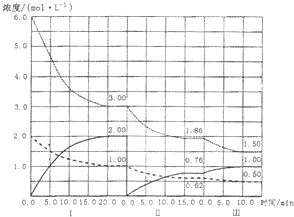
(6分)由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。
(1)在250C、101KPa时,3.2克甲醇(CH30H)完全燃烧生成CO2和液态水时放热72.576kJ,则能表示甲醇燃烧的热化学方程式为___________________。
(2)为探究反应原理,现进行如下实验,在体积为2 L的密闭容器中,充入2mol
CO2和6mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=—49kJ/mol,测得CO2和H2O
(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) △H=—49kJ/mol,测得CO2和H2O
(g)的浓度随时间变化如图所示。

①从反应开始到平衡,氢气的平均反应速率v(H2)=__________mol/(L·min)。
②下列措施中能使n(H2O)/n(CO2)增大的是________。
A.升高温度 B.再充入3mol H2
C.将CH3OH (g)从体系中分离 D.充入He(g),使体系压强增大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com