
题目列表(包括答案和解析)

试回答下列问题:
(1)在NaCl晶体中,每个Na+同时吸引个________Cl-,而Na+数目与Cl-数目之比为__________。
(2)Na+半径与Cl-半径之比![]() =__________。(已知
=__________。(已知![]() =1.414,
=1.414,![]() =1.732,
=1.732,![]() =2.236)
=2.236)
(3)NaCl晶体不存在分子,但在温度达到1 413 ℃时,NaCl晶体形成气体,并以分子形式存在,现有29.25 g NaCl晶体,强热使温度达到1 450 ℃,测得气体体积为5.6 L(已折算为标准状况),则此时氯化钠气体的分子式(化学式)为__________。

 = 1.414,
= 1.414,  =1.732,
=1.732, 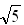 =2.236)
=2.236) (2004·烟台)在离子晶体中,阴、阳离子按一定规律在空间排列,下图A是NaCl的晶体结构,在离子晶体中,阴、阳离子具有或近似具有球形对称结构,它们可以被看作是不等径的刚性圆球,并彼此相切如NaCl晶体结构如图B,已知a为常数.

(1)在NaCl晶体中,每个 同时吸引_______个
同时吸引_______个 ;而
;而 数目和
数目和 数目之比为_______.
数目之比为_______.
(2) 半径与
半径与 半径之比
半径之比 =______________(已知
=______________(已知 ).
).
(3)NaCl晶体中不存在分子,但在 ,1 413℃时,NaCl晶体形成气体,并以分子形式存在.现有29.25g NaCl晶体,在
,1 413℃时,NaCl晶体形成气体,并以分子形式存在.现有29.25g NaCl晶体,在 时强热使温度达到1 501.5℃,测得气体体积为36.4L,试应用有关物理、化学知识计算此时氯化钠气体的分子式(化学式)为______(不写计算过程).
时强热使温度达到1 501.5℃,测得气体体积为36.4L,试应用有关物理、化学知识计算此时氯化钠气体的分子式(化学式)为______(不写计算过程).
(4)若 ,求NaCl晶体的密度(已知
,求NaCl晶体的密度(已知 ,NaCl的摩尔质量为
,NaCl的摩尔质量为 ).
).

(15分)新型锂离子电池在新能源的开发中占有重要地位。可用作节能环保电动汽车的动力电池。磷酸亚铁锂(LiFePO4)是新型锂离子电池的首选电极材料,它的制备方法如下:
方法一:将碳酸锂、乙酸亚铁[(CH3COO)![]() Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出。
Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出。
![]() 方法二:将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀。沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂。
方法二:将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀。沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂。
![]() 在锂离子电池中,需要一种有机聚合物作为正负极之间锂离子选移的介质,该有机聚合物的单体之一(用M表示)的结构简式如下:
在锂离子电池中,需要一种有机聚合物作为正负极之间锂离子选移的介质,该有机聚合物的单体之一(用M表示)的结构简式如下:
![]()

请回答下列问题:
(1)上述两种方法制备磷酸亚铁锂的过程都必须在惰性气体氛围中进行。其原因是
。
(2)在方法一所发生的反应中,除生成磷酸亚铁锂、乙酸外,还有 、 (填化学式)生成。
(3)在方法二中,阳极生成磷酸亚铁锂的电极反应式为
。
(4)写出M与足量氧化钠溶液反应的化学方程式:
。
(5)已知该锂离子电池在充电过程中,阳极的磷酸亚铁锂生成磷酸铁,则该电池放电时正极的电极反应式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com