
题目列表(包括答案和解析)
(1)家用液化气的主要成分之一是丁烷(C4H10),当1 kg丁烷完全燃烧生成二氧化碳和液态水时,放出热量为5×104kJ,试写出表示丁烷燃烧热的热化学方程式:
(2)运用盖斯定律可计算一些不易测定的反应的反应热。
已知在298K时下述反应的有关数据:C(s) + ![]() O2(g)=CO(g) △H1=-110.5 kJ·mol-1,
O2(g)=CO(g) △H1=-110.5 kJ·mol-1,
C(s) + O2(g)=CO2(g) △H2=-393.5 kJ·mol-1。则C(s) + CO2(g)=2CO(g) 的△H为 。
(3)已知下列两个热化学方程式:
H2(g)+![]() O2(g)===H2O(l) ΔH=-285 kJ/mol
O2(g)===H2O(l) ΔH=-285 kJ/mol
C3H8(g)+5O2(g)==3CO2(g)+4H2O(l) ΔH=-2220.0 kJ/mol
已知:H2O(l)==H2O(g) ΔH=+44.0 kJ/mol,写出丙烷燃烧生成CO2和气态水的热化学方程式: 。
| 1 | 2 |

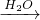 CuCl↓+Cl-.
CuCl↓+Cl-.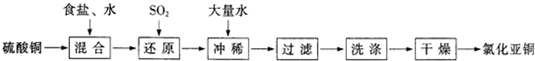
| H2O |
 CuCl↓+Cl-.
CuCl↓+Cl-.湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com