
题目列表(包括答案和解析)
(11分)
(1)已知H2(g)+Br2(1)2HBr(g) △H=-72kJ/mol,蒸发1mol Br2(1)需要吸收的能量为30kJ,其它相关数据如下表:
|
|
H2(g) |
Br2(g) |
HBr(g) |
|
键能/kJ·mol-1 |
436 |
a |
369 |
①Br2(1)=Br2(g) △H1,则△H1=_____________;
②写出H2(g)与Br2(g)反应生成HBr(g)的热化学方程式:_____________________________
③试计算a=_________________。
(2)磷在氧气中燃烧,可能生成两种固态氧化物。3.1g的单质磷(P)在一定量氧气中燃烧生成P2O3、P2O5各0.025mol,反应物完全耗尽,并放出X kJ热量。
①已知1mol磷完全燃烧生成稳定氧化物放出的热量为Y kJ,则1molP与O2反应生成固态P2O3的反应热△H=________________________________。
②写出1mol P与O2反应生成固态P2O3的热化学方程式:
___________________________________________________________________
(11分)(1)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g)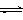 CH3OH(g)+H2O(g) ,△H=-49.0kJ/mol;测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ,△H=-49.0kJ/mol;测得CO2和CH3OH(g)的浓度随时间变化如图所示。
①从反应开始到平衡,平均反应速率v(CO2)= mol/(L·min)。
②该反应的平衡常数表达式为________________________________________。
③下列措施中能使n(CH3OH)/n(CO2)增大的是 。
| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离 | D.再充入1mol H2 |
 消除CO的污染。请你判
消除CO的污染。请你判 断是否可行并说出理由: , 。
断是否可行并说出理由: , 。(方程式2分,其余每空1分,共11分)
(1)空气污染指数是根据空气中 、 、 等污染物的浓度计算出来的数值。
(2)糖类可分为 、 和 。蔗糖、麦芽糖和乳糖属于 。
(3)下表是我国部分城市空气质量周报,阅读并回答下列问题:
|
城市 |
污染 指数 |
首要 污染物 |
空气质量级别 |
城市 |
污染 指数 |
首要 污染物 |
空气质量级别 |
|
北京 |
92 |
TSP |
II |
济南 |
76 |
TSP |
II |
|
天津 |
82 |
TSP |
II |
武汉 |
83 |
NOx |
II |
|
哈尔滨 |
96 |
TSP |
II |
重庆 |
98 |
SOx |
II |
|
上海 |
74 |
NOx |
II |
长沙 |
61 |
TSP |
II |
|
注:TSP——空气中的飘尘 |
①最容易出现酸雨的城市是 ;为减少城市酸雨的产生,可采取以下措施中的 。
A.改善燃煤质量,限制高硫煤炭的开采 B.禁止用煤作燃料
C.调整和优化能源结构,加快开发和利用新能源。 D.向已酸化的土壤中加石灰
②汽车尾气(含有CO、SO2与NO等物质)是城市空气的污染物,治理的方法之一是在汽车的排气管上装一个催化转换器,其特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,写出CO与NO反应的化学方程式_______________________ 。
(11分) (1)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g)CH3OH(g)+H2O(g) ,△H=-49.0kJ/mol;测得CO2和CH3OH(g)的浓度随时间变化如图所示。
①从反应开始到平衡,平均反应速率v(CO2)= mol/(L·min)。
②该反应的平衡常数表达式为________________________________________。
③下列措施中能使n(CH3OH)/n(CO2)增大的是 。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol H2
(2)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2 ,CO可用作燃料。
已知该反应的阳极反应为:4OH――4e―=O2↑+2H2O
则阴极反应式为: 。
有人提出,可以设计反应2CO=2C+O2(△H>0、△S<0)来消除CO的污染。请你判断是否可行并说出理由: , 。
(11分) (1)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ,△H=-49.0kJ/mol;测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ,△H=-49.0kJ/mol;测得CO2和CH3OH(g)的浓度随时间变化如图所示。

①从反应开始到平衡,平均反应速率v(CO2)= mol/(L·min)。
②该反应的平衡常数表达式为________________________________________。
③下列措施中能使n(CH3OH)/n(CO2)增大的是 。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol H2
(2)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2 ,CO可用作燃料。
已知该反应的阳极反应为:4OH――4e―=O2↑+2H2O
则阴极反应式为: 。
有人提出,可以设计反应2CO=2C+O2(△H>0、△S<0)来消除CO的污染。请你判断是否可行并说出理由: , 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com