(1)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液.向其中加入少量酸或碱时,溶液的酸碱性变化不大.现将0.04mol?L
-1HA溶液和0.02mol?L
-1NaOH溶液等体积混合,得到缓冲溶液.
①若HA为HCN,该溶液显碱性,则溶液中c(CN
-)
c(Na
+)(填“<”、“=”或“>”),你得出该结论的依据是
.
②若HA为CH
3COOH,该溶液显酸性.溶液中所有的离子按浓度由大到小排列的顺序是
.
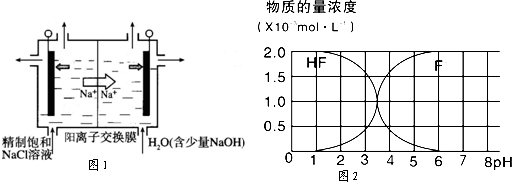
(2)二氧化氯(ClO
2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂,目前已开发出用电解法制取ClO
2的新工艺.
①如图示意用石墨做电极,在一定条件下电解饱和食盐水制取ClO
2.写出阳极产生ClO
2的电极反应式:
.
②电解一段时间,当阴极产生的气体体积为336mL(标准状况)时,停止电解.通过阳离子交换膜的阳离子的物质的量为
mol;用平衡移动原理解释阴极区pH增大的原因
.
(3)25℃时,2.0×10
-3mol?L
-1HF溶液中,调节溶液pH(忽略溶液体积变化)得到的(HF)、c(F
-)与溶液pH的变化关系如图2.若将4.0×10
-4mol?L
-1CaCl
2溶液与4.0×10
-3mol?L
-1HF溶液等体积混合,调节混合液pH=4(忽略调节时混合液体积的变化),通过列式计算说明是否有CaF
2沉淀析出.[已知K
sp(CaF
2):1.5×10
-10]
.

 I.常温下在20mL0.1mol?L-1Na2CO3溶液中逐滴加入0.1mol?L-1 HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示.回答下列问题:
I.常温下在20mL0.1mol?L-1Na2CO3溶液中逐滴加入0.1mol?L-1 HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示.回答下列问题: H++HA- HA-
H++HA- HA- H++A2-
H++A2-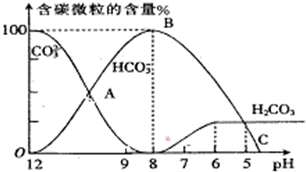 I.常温下在20mL0.1mol?L-1Na2CO3溶液中逐滴加入0.1mol?L-1 HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示.回答下列问题:
I.常温下在20mL0.1mol?L-1Na2CO3溶液中逐滴加入0.1mol?L-1 HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示.回答下列问题: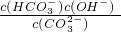 =2×10-4,当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH=______.
=2×10-4,当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH=______.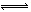 H++HA- HA-
H++HA- HA- H++A2-
H++A2- =2×10-4,当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH=______.
=2×10-4,当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH=______. H++HA- HA-
H++HA- HA- H++A2-
H++A2-
