
题目列表(包括答案和解析)

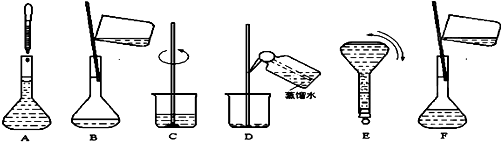

(18分)为了测定某未知NaOH溶液的浓度,需要0.200mol·L-1的盐酸溶液500mL。某学生用实验室中常用的36.5%(密度为1.20g·cm-3)的浓盐酸配制所需稀盐酸,并设计了以下步骤完成实验。
⑴请你帮助该同学完成以下各步中的内容,并将其所设计的实验步骤正确排序。
A.用_____(从以下备选仪器中选取适当仪器,将其序号填入空格中)量取36.5%(密度为1.20g·cm-3)的浓盐酸________mL。a.50mL量筒; b.10mL量筒; c.托盘天平。
B.将取好的浓盐酸在烧杯中加适量蒸馏水稀释。
C.轻轻振荡后继续加蒸馏水到液面距离仪器刻线1~2cm处。
D.等溶液恢复至室温。
E.将溶液用玻璃棒引流转入______________________(填写所需仪器)中,再用适量蒸馏水洗涤烧杯和玻璃棒2~3次一并转入其中。
F.用胶头滴管加蒸馏水直到溶液液面恰好与刻线相切,塞好瓶塞摇匀即可。
以上各实验步骤的正确排列顺序是___________________________________。
⑵准确移取20.00mL待测NaOH溶液于锥形瓶中,用所配标准盐酸溶液进行滴定(以酚酞为指示剂)。滴定结果如下表:据此计算未知NaOH溶液的物质的量浓度为____mol·L-1(精确到0.01)。
| 实验序号 | 滴定管液面起始读数 | 滴定管液面终点读数 |
| 1 | 1.32mL | 23.36mL |
| 2 | 2.26mL | 24.22mL |
⑶下列操作或叙述正确的是_____(填写序号)。
A.滴定过程中,眼睛注视滴定管内溶液并使视线与液面的凹面水平。
B.滴定过程中由于摇动锥形瓶使少许溶液溅起沾在瓶内壁,为使测定结果正确,可用少许蒸馏水将其冲入锥形瓶内的溶液中。
C.容量瓶和滴定管在使用前洗净后都要检查是否漏液。
D.向锥形瓶中移取NaOH溶液前,用少许NaOH溶液润洗锥形瓶2~3次。
⑷下列操作或现象会导致测定结果偏高的是_____________________(填写序号)。
A.滴定过程中不小心将一滴溶液滴在锥形瓶外;
B.滴定结束时,发现在滴定管尖嘴处有小气泡;
C.滴定结束后仰视滴定管液面读数;
D.溶液褪色立即读数,摇动锥形瓶后看到溶液红色复出;
E.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗,直接加入标准液进行滴定。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com