
题目列表(包括答案和解析)
⑴北京奥运会祥云火炬将中国传
统文化、奥运精神以及现代高科技融为一体。
 火炬内熊熊大火来源于丙烷的燃烧,丙烷是
火炬内熊熊大火来源于丙烷的燃烧,丙烷是
一种优良的燃料。试回答下列问题:
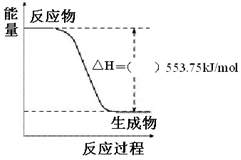
① 右图是一定量丙烷完全燃烧生成
CO2和1mol H2O(l)过程中的能量变化图,请在附图中的括号内填入“+”或“—”。
②写出表示丙烷燃烧热的热化学方程式:
___________________________________。
③二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1mol二甲醚完全燃烧生成CO2和液态水放出1455kJ热量。若1mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1645kJ热量,则混合气体中,丙烷和二甲醚的物质的量之比为_______。
⑵盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
已知: H2O(g)=H2O(l) △H1=-Q1kJ/mol
C2H5OH(g)=C2H5OH(l) △H2=-Q2 kJ/mol
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) △H3=-Q3 kJ/mol
若使23g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为____________kJ。
⑴北京奥运会祥云火炬将中国传
统文化、奥运精神以及现代高科技融为一体。
 火炬内熊熊大火来源于丙烷的燃烧,丙烷是
火炬内熊熊大火来源于丙烷的燃烧,丙烷是
一种优良的燃料。试回答下列问题:
① 右图是一定量丙烷完全燃烧生成
CO2和1mol H2O(l)过程中的能量变化图,请在附图中的括号内填入“+”或“—”。
②写出表示丙烷燃烧热的热化学方程式:
___________________________________。
③二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1mol二甲醚完全燃烧生成CO2和液态水放出1455kJ热量。若1mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1645kJ热量,则混合气体中,丙烷和二甲醚的物质的量之比为_______。
⑵盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
已知: H2O(g)=H2O (l) △H1=-Q1 kJ/mol
C2H5OH(g)=C2H5OH (l) △H2=-Q2 kJ/mol
C2H5OH (g)+3O2(g)=2CO2(g)+3H2O(g) △H3=-Q3 kJ/mol
若使23g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为____________kJ。

A.“祥云”火炬使用燃料为丙烷,这是一种价格低廉的常用燃料而且燃烧充分,对环境不造成污染
B.“祥云”火炬的外形材料为轻薄高品质铝合金和中空塑件设计均为可回收的环保材料
C.“祥云”火炬的手柄用高触感橡胶漆喷涂,防滑,手感舒适
D.“祥云”火炬的外壳采用了铝材的氧化着色技术,但会缩短火炬的使用寿命
(1)北京奥运会祥云火炬将中国传统文化、奥运精神以及现代高科技融为一体。火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料。试回答下列问题:
①右图是一定量丙烷完全燃烧生成CO2和1mol H2O(l)过程中的能量变化图,请在附图中的括号内填入“+”或“—”。

②写出表示丙烷燃烧热的热化学方程式:
___________________________________。
③二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1mol二甲醚完全燃烧生成CO2和液态水放出1455kJ热量。若1mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1645kJ热量,则混合气体中,丙烷和二甲醚的物质的量之比为_______。
(2)盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
已知: H2O(g)=H2O (l) △H1=-Q1 kJ/mol
C2H5OH(g)=C2H5OH (l) △H2=-Q2 kJ/mol
C2H5OH (g)+3O2(g)=2CO2(g)+3H2O(g) △H3=-Q3 kJ/mol
若使23g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为____________kJ。
(1)北京奥运会祥云火炬将中国传统文化、奥运精神以及现代高科技融为一体。火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料。试回答下列问题:
①右图是一定量丙烷完全燃烧生成CO2和1mol H2O(l)过程中的能量变化图,请在附图中的括号内填入“+”或“—”。
②写出表示丙烷燃烧热的热化学方程式:
___________________________________。
③二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1mol二甲醚完全燃烧生成CO2和液态水放出1455kJ热量。若1mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1645kJ热量,则混合气体中,丙烷和二甲醚的物质的量之比为_______。
(2)盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
已知: H2O(g)=H2O(l) △H1=-Q1kJ/mol
C2H5OH(g)=C2H5OH(l) △H2=-Q2kJ/mol
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) △H3=-Q3kJ/mol
若使23g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为____________kJ。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com