
题目列表(包括答案和解析)
(8分)重晶石(主要成分是BaSO4)是制备钡化合物的重要原料,但BaSO4不溶于水也不溶于酸,这给转化为其他钡盐带来了困难,工业上用饱和Na2CO3溶液处理BaSO4沉淀,待达到平衡后,移走上层清夜,重复多次操作,将其转化为易溶于酸的BaCO3,再由BaCO3制备其它钡盐。
Ksp(BaSO4)=1.0×10-10 Ksp(BaCO3)=5.0×10-10
(1)写出沉淀转化的方程式: ,此反应平衡常数K的值为 。
(2)要实现该转化C(CO32-)不低于 mol/L
(3)必须更换Na2CO3溶液的原因是什么?
(8分)重晶石(主要成分是BaSO4)是制备钡化合物的重要原料,但BaSO4不溶于水也不溶于酸,这给转化为其他钡盐带来了困难,工业上用饱和Na2CO3溶液处理BaSO4沉淀,待达到平衡后,移走上层清夜,重复多次操作,将其转化为易溶于酸的BaCO3,再由BaCO3制备其它钡盐。
Ksp(BaSO4)=1.0×10-10 Ksp(BaCO3)=5.0×10-10
(1)写出沉淀转化的方程式: ,此反应平衡常数K 的值为 。
(2)要实现该转化C(CO32-)不低于 mol/L
(3)必须更换Na2CO3溶液的原因是什么?
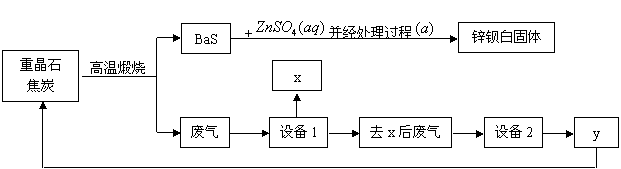
 锌钡白是BaSO4和ZnS的混合物,ZnS难溶于水。某化工厂用重晶石为原料制备锌钡白,生产过程中会产生大量废气(主要成分为CO2、CO及少量SO2和硫蒸气等),为防止污染空气并提高原料利用率,生产中采用下述工艺流程:
锌钡白是BaSO4和ZnS的混合物,ZnS难溶于水。某化工厂用重晶石为原料制备锌钡白,生产过程中会产生大量废气(主要成分为CO2、CO及少量SO2和硫蒸气等),为防止污染空气并提高原料利用率,生产中采用下述工艺流程:
请根据上述流程回答下列问题:
(1)重晶石的化学式为_______,锌钡白可用于调制_____色和浅色油漆。
(2)处理过程![]() 的步骤为:①_________;②洗涤;③______________。
的步骤为:①_________;②洗涤;③______________。
(3)设备1是冷却分离塔,若设备1前面的导气管过长、过窄,可能使导气管堵塞,其原因是 。
(4)检验锌钡白中含有S2-的方法是 。
(5)设备2中所用的洗涤剂是NaOH溶液,则y的化学式为________。写出设备2中发生反应的离子方程式:___________________________________、_________________________________。
(6)可用 法分离溶液中的钠盐,进行分离前,需要查得的数据是 。
(7)制备过程中得到的硫磺,除了可用来制硫酸外,其它的用途为____ (至少写一种)。
 锌钡白是BaSO4和ZnS的混合物,ZnS难溶于水。某化工厂用重晶石为原料制备锌钡白,生产过程中会产生大量废气(主要成分为CO2、CO及少量SO2和硫蒸气等),为防止污染空气并提高原料利用率,生产中采用下述工艺流程:
锌钡白是BaSO4和ZnS的混合物,ZnS难溶于水。某化工厂用重晶石为原料制备锌钡白,生产过程中会产生大量废气(主要成分为CO2、CO及少量SO2和硫蒸气等),为防止污染空气并提高原料利用率,生产中采用下述工艺流程:
请根据上述流程回答下列问题:
(1)重晶石的化学式为_______,锌钡白可用于调制_____色和浅色油漆。
(2)处理过程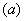 的步骤为:①_________;②洗涤;③______________。
的步骤为:①_________;②洗涤;③______________。
(3)设备1是冷却分离塔,若设备1前面的导气管过长、过窄,可能使导气管堵塞,其原因是 。
(4)检验锌钡白中含有S2-的方法是 。
(5)设备2中所用的洗涤剂是NaOH溶液,则y的化学式为________。写出设备2中发生反应的离子方程式:___________________________________、_________________________________。
(6)可用 法分离溶液中的钠盐,进行分离前,需要查得的数据是 。
(7)制备过程中得到的硫磺,除了可用来制硫酸外,其它的用途为____ (至少写一种)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com