(1)恒温,容积为1L恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示.(已知:2SO
2(g)+O
2(g)?2SO
3(g)△H=-196.6KJ?mol
- 1),请回答下列问题:

①写出能表示硫的燃烧热的热化学方程式:
.
②△H
2=
KJ?mol
-1③在相同条件下,充入1molSO
3和0.5mol的O
2则达到平衡时SO
3的转化率为
;此时该反应
(填“放出”或“吸收”)
kJ的能量.
(2)中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.
①有效“减碳”的手段之一是节能,下列制氢方法最节能的是
(填序号)
A.电解水制氢:2H
2O
2H
2↑+O
2↑
B.高温使水分解制氢:2H
2O
2H
2↑+O
2↑
C.太阳光催化分解水制氢:2H
2O
2H
2↑+O
2↑
D.天然气制氢:CH
4+H
2O
CO+3H
2②CO
2可转化成有机物实现碳循环.在体积为1L的密闭容器中,充入1mol CO
2和3mol H
2,一定条件下反应:CO
2(g)+3H
2(g)?CH
3OH(g)+H
2O(g)△H=-49.0kJ?mol
-1,测得CO
2和CH
3OH(g)浓度随时间变化如上图2所示.从3min到9min,v(H
2)=
mol?L
-1?min
-1.
③能说明上述反应达到平衡状态的是
(填编号).
A.反应中CO
2与CH
3OH的物质的量浓度之比为1:1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3mol H
2,同时生成1mol H
2O
D.CO
2的体积分数在混合气体中保持不变
(3)工业上,CH
3OH也可由CO和H
2合成.参考合成反应CO(g)+2H
2(g)?CH
3OH(g)的平衡常数:下列说法正确的是
.
| 温度/℃ |
0 |
100 |
200 |
300 |
400 |
| 平衡常数 |
667 |
13 |
1.9×10-2 |
2.4×10-4 |
1×10-5 |
A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行,说明该反应△S<0
C.在T℃时,1L密闭容器中,投入0.1mol CO和0.2mol H
2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5Mpa)和250℃,是因为此条件下,原料气转化率最高.


 2H2↑+O2↑
2H2↑+O2↑ 2H2↑+O2↑
2H2↑+O2↑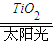 2H2↑+O2↑
2H2↑+O2↑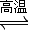 CO+3H2
CO+3H2
 2H2↑+O2↑
2H2↑+O2↑ 2H2↑+O2↑
2H2↑+O2↑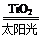 2H2↑+O2↑
2H2↑+O2↑ CO+3H2
CO+3H2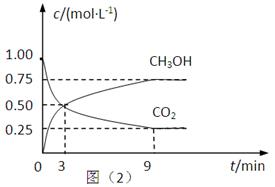
 CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1,测得CO2和CH3OH(g)的浓度随时间变化如上图所示。
CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1,测得CO2和CH3OH(g)的浓度随时间变化如上图所示。 CH3OH(g)的平衡常数:
CH3OH(g)的平衡常数: