
题目列表(包括答案和解析)
向25 mL某浓度的稀盐酸中逐滴滴入0.20 mol·L-1NaOH溶液,用酚酞作指示剂,以测该盐酸的物质的量浓度.滴定后计算知该稀酸浓度为0.10 mol·L-1.
(1)在下面实验通知单中,写出所需仪器名称、数量以及玻璃仪器规格.
化学实验通知单(部分内容)
|
药品或仪器 |
数量 |
规格 |
|
铁架台(带滴定管夹) |
|
|
|
酸式滴定管 |
|
|
|
碱式滴定管 |
|
|
|
锥形瓶 |
|
|
(2)在下图中画出滴定过程中,pH随滴入NaOH(标况)体积V的变化曲线,假设V体积由0 mL逐渐滴至20 mL.(已知lg3=0.5)

(1)在下面实验通知单中,写出所需仪器名称、数量以及玻璃仪器规格.
化学实验通知单(部分内容)
|
药品或仪器 |
数量 |
规格 |
|
铁架台(带滴定管夹) |
|
|
|
酸式滴定管 |
|
|
|
碱式滴定管 |
|
|
|
锥形瓶 |
|
|
(2)在下图中画出滴定过程中,pH随滴入NaOH(标况)体积V的变化曲线,假设V体积由0 mL逐渐滴至20 mL.(已知lg3=0.5)

某食用白醋是由醋酸与纯水配制而成,用0.1000 mol/L NaOH溶液准确测定其中醋酸的物质的量浓度。以下为某同学列出的实验步骤(未排序),请回答下列问题。
A.分别向碱式滴定管、酸式滴定管注入NaOH标准溶液和待测醋酸至0刻度以上2~3cm
B.调节滴定管液面至0或0刻度以下,记下读数
C.用NaOH标准溶液滴定至终点,记下滴定管液面的刻度
D.用标准溶液清洗碱式滴定管2~3次;待测醋酸清洗酸式滴定管2~3次
E.用待测醋酸清洗锥形瓶2~3次
F.排气泡使滴定管尖嘴充满溶液,把滴定管固定好
G.滴定管检漏,用水清洗所有仪器,备用
H.通过酸式滴定管向锥形瓶注入20.00 mL待测醋酸,并加入2-3滴指示剂
(1)用离子方程式表示该实验的原理 。
(2)从上述实验步骤中选出正确的并按操作先后排序。你的实验顺序为:(用字母
表示) 。
(3)实验室常用的酸碱指示剂有甲基橙、石蕊和酚酞,你选择的指示剂是________,
理由是_______________________________________________________________ ;
滴定终点的现象是______________________________________________________。
(4)某同学实验后得到的数据如下:
|
滴定次数 实验数据 |
1 |
2 |
3 |
4 |
5 |
|
V(NaOH) /mL(初读数) |
0.00 |
0.20 |
0.00 |
0.10 |
0.05 |
|
V(NaOH) /mL(终读数) |
15.75 |
15.20 |
14.98 |
15.12 |
15.05 |
原白醋中醋酸的物质的量浓度为____________mol/L(结果保留4位有效数字)。
(5)分析下列操作对测定结果的影响,用“偏低”、“偏高”或“不影响”填空。
①滴定前碱式滴定管充满溶液,滴定后尖嘴处有气泡_______;
②读取标准溶液体积时,滴定前平视,滴定后仰视________。
实验测定酸碱中和滴定曲线是高中化学的重要定量实验。下表是用0.10 mol/L的盐酸滴定 0.10 mol/L 20.00 mL NaOH 溶液时获得的一些相关数据。请回答下列问题:
(1)填写表中①②对应的 pH (结果保留两位小数)
(2)下图是本实验的滴定曲线图。请根据该图,说明强酸溶液滴定强碱溶液时,为什么既可以使用甲基橙作为指示剂,又可以使用酚酞试液作指示剂来指示滴定终点?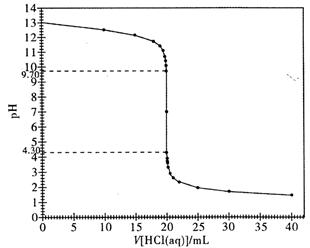
(3)若在滴定终点时俯视读数,最终测得的氢氧化钠溶液的浓度会 (填“偏大”、“偏小”或“没有影响”,下同);若滴定结束时,滴定管尖嘴悬有半滴标准盐酸,最终测得的氢氧化钠溶液的浓度会;若盛装待测液的锥形瓶洗涤干净后,未干燥即盛装待测液,最终测得的氢氧化钠溶液的浓度会 。
实验测定酸碱中和滴定曲线是高中化学的重要定量实验。下表是用0.10 mol/L的盐酸滴定 0.10 mol/L 20.00 mL NaOH 溶液时获得的一些相关数据。请回答下列问题:
(1)填写表中①②对应的 pH (结果保留两位小数)

(2)下图是本实验的滴定曲线图。请根据该图,说明强酸溶液滴定强碱溶液时,为什么既可以使用甲基橙作为指示剂,又可以使用酚酞试液作指示剂来指示滴定终点?

(3)若在滴定终点时俯视读数,最终测得的氢氧化钠溶液的浓度会 (填“偏大”、“偏小”或“没有影响”,下同);若滴定结束时,滴定管尖嘴悬有半滴标准盐酸,最终测得的氢氧化钠溶液的浓度会;若盛装待测液的锥形瓶洗涤干净后,未干燥即盛装待测液,最终测得的氢氧化钠溶液的浓度会 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com