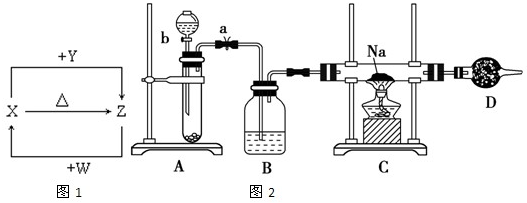
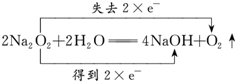X、Y、Z、W四种化合物均由1~18号元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体.这四种化合物具有下列转化关系如图1(部分反应物、产物及反应条件已略去).请回答:
(1)W的分子式是
CO2
CO2
.
(2)X与Y在溶液中反应的离子方程式是
HCO3-+OH-=CO32-+H2O
HCO3-+OH-=CO32-+H2O
.
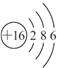
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用图2装置快速制取少量的O
2,并演示Na在O
2中的燃烧实验.
①关闭装置中的止水夹a后,开启活塞b,漏斗中液体不断地往下滴,直至全部流入试管.试判断装置是否漏气
漏气
漏气
(填“漏气”、“不漏气”或“无法确定”),判断理由是
漏斗中的液体能全部流入试管说明试管中压强与外界相同
漏斗中的液体能全部流入试管说明试管中压强与外界相同
.
②写出A装置中反应的化学方程式并标出电子得失情况:
.
③C装置中观察到的现象是
剧烈燃烧,发出黄光,有淡黄色物质生成;
剧烈燃烧,发出黄光,有淡黄色物质生成;
.
④D装置中盛放的试剂是
碱石灰
碱石灰
,其作用是
防止空气中的H2O、CO2进入C装置
防止空气中的H2O、CO2进入C装置
.
(4)向Z溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有X生成,该反应的化学方程式是
2Na2CO3+Cl2+H2O=NaClO+NaCl+2NaHCO3
2Na2CO3+Cl2+H2O=NaClO+NaCl+2NaHCO3
.