
题目列表(包括答案和解析)
(共10分)下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
|
A |
|
|
|||||||||||||||
|
B |
|
|
|
C |
D |
E |
F |
|
|||||||||
|
G |
H |
I |
J |
|
K |
L |
|
||||||||||
|
|
|
|
|
|
M |
|
N |
|
|
|
|
|
|
|
|
|
|
试回答下列问题:
(1)请写出元素N的基态原子电子排布式 。
(2)D的氢化物易溶于水的原因
(3)D和E的电负性的大小: > (用元素符号表示)
(4)由A、C、D形成的ACD分子中,含有 个σ键, 个π键。
(5)元素M的化合物(MO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。请回答下列问题:
①与M同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有 __________(填元素符号),其中一种金属的晶胞结构如图所示,该晶胞中含有金属原子的数目为 。

②MO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断MO2Cl2是__________(填“极性”或“非极性”)分子。
③在①苯、②CH3OH、③HCHO、④CS2、⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有___________(填序号),CS2分子的空间构型是__________。
(14分)下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
|
A |
|
|
|||||||||||||||
|
B |
|
|
|
C |
D |
E |
F |
|
|||||||||
|
G |
H |
I |
J |
|
K |
L |
|
||||||||||
|
|
|
|
|
|
M |
|
|
N |
|
|
|
|
|
|
|
|
|
试回答下列问题:
(1)请写出元素N的基态原子电子排布式________________________________。
(2)元素B、G形成的单质熔点更高的是______________(填化学式),原因是____________________
(3)ME2L2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断ME2L2是__________(填“极性”或“非极性”)分子。
(4)在①苯、②CH3OH、③HCHO、④CS2、⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有___________(填序号),CS2分子的空间构型是__________。
(5)元素N可以形成分子式为Co(NH3)5BrSO4,配位数均为6的两种配合物,若往其中一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则该配合物的化学式为_____________________。
考生从两道化学题中各任选一题作答
1[化学——物质结构与性质]Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
①Z的原子序数为29,其余的均为短周期主族元素;
②Y原子价电子(外围电子)排布为msnmpn;
③R原子核外L层电子数为奇数;
④Q、X原子p轨道的电子数分别为2和4。
请回答下列问题:
(1)Z2+的核外电子排布式是___________。
(2)在[Z(NH3)4]2+离子中,Z2+的空轨道接受NH3分子提供的_________形成配位键。
(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是_________。
a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(4)Q、R、Y三种元素的第一电离能数值由小至大的顺序为_________(用元素符号作答)。
(5)Q的一种氢化物相对分子质量为26,其分子中σ键与π键的键数之比为_________。
(6)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于_________(填晶体类型)。
2[化学——有机化学基础]有机物A是常用的食用油抗氧化剂,分子式为C10H12O5,可发生如下转化:

已知B的相对分子质量为60,分子中只含一个甲基。C的结构可表示为: 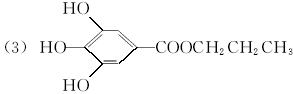 (其中:—X、—Y均为官能团)。
(其中:—X、—Y均为官能团)。
请回答下列问题:
(1)根据系统命名法,B的名称为________________。
(2)官能团—X的名称为____________,高聚物E的链节为____________。
(3)A的结构简式为________________________。
(4)反应⑤的化学方程式为____________________________________。
(5)C有多种同分异构体,写出其中2种符合下列要求的同分异构体的结构简式。
ⅰ.含有苯环 ⅱ.能发生银镜反应 ⅲ.不能发生水解反应
(6)从分子结构上看,A具有抗氧化作用的主要原因是____________(填序号)。
a.含有苯环 b.含有羰基 c.含有酚羟基
(14分).A、B、C、 D、 E五种溶液分别是NaOH、 NH3·H2O、 CH3COOH 、HCl 、NH4HSO4中的一种。常温下进行下列实验:
①将1 L pH=3的A溶液分别与0.001mol·L-1 xL B溶液、0.001mol·L-1 yL D溶液充
分反应至中性,x、y大小关系为: y<x;
②浓度均为0.1mol·L-1A和E溶液,pH:A<E;
③浓度均为0.1mol·L-1C与D溶液等体积混合,溶液呈酸性。
回答下列问题:
(1)D是 溶液,判断理由是 。
(2) 用水稀释0.1 mol·L-1B时,溶液中随着水量的增加而减小的是 (填写序号)
① ;
②
;
② 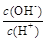 ;
;
③ c(H+)和c(OH-)的乘积 ④ OH-的物质的量
(3)OH-浓度相同的等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是________(填写序号)
①反应所需要的时间E>A ②开始反应时的速率A>E
③参加反应的锌粉物质的量A=E ④反应过程的平均速率 E>A
⑤A溶液里有锌粉剩余 ⑥E溶液里有锌粉剩余
(4)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解)溶液pH随温度变化如下图中的_________曲线(填写序号) 。
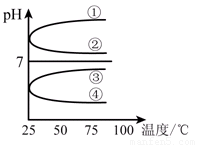
(5)室温下,向0.01mol·L-1 C溶液中滴加0.01mol·L-1 D溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为_______________。
(5分) Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
①Z的原子序数为29,其余的均为短周期主族元素;
② Y原子价电子排布为msnmpn ;
③ R原子核外L层电子数为奇数;
④ Q、X原子p轨道的电子数分别为2和4。
请回答下列问题:
(1)Z在周期表中第 族。
(2)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是 。(填写序号)
a.稳定性:甲>乙,沸点:甲<乙 b.稳定性:甲>乙,沸点:甲>乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(3)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为 。
(4)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于 , 1 mol该晶体中含有 mol的化学键
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com