
题目列表(包括答案和解析)
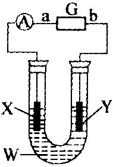
(1)利用电解原理在如图装置中完成粗铜提纯,则电解质溶液W为_________,阳极材料X为_________;
(2)已知直流电源G为高铁电池,高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压,高铁电池的总反应式为:
3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH则b电极反应式为_________;放电时每转移3 mol电子,正极有_________mol_________被还原;
3Zn(OH)2+2Fe(OH)3+4KOH则b电极反应式为_________;放电时每转移3 mol电子,正极有_________mol_________被还原;
(3)若X、X为石墨板,W为CuSO4溶液,电解一段时间后,向电解后的残留液中加入足量铁粉充分反应,过滤、蒸干、称重,发现铁粉增重3.2g;洗净、烘干、称重,发现Y板增重1.6 g。则从理论上讲,电解过程中高铁电池的锌电极质量减少_________g;电解后溶液pH为_________;原CuSO4溶液的物质的量浓度为_________mol·L-1。
过氧化尿素是一种无毒无味的白色粉末,是一种新型的漂白剂与消毒剂。它的合成方式如下:
请回答下列问题:
(1)根据反应原理,CO(NH2)2·H2O2分子内存在的作用力
是 。
A.共价键 B.离子键
C.金属键 D.氢键
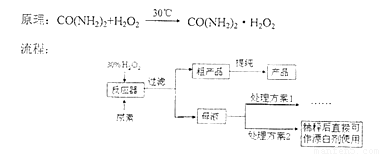
(2)流程图中反应器的装置如图所示,推测该反应的加热方式是 ;回流管中冷水流从 口流入;搅拌器选用的材质是玻璃而不是铁质或铝质材料的原因是 。
(3)母液处理方案1可以是 (用文字表达)。若欲从母液中离出H2O2和尿素,可采用的操作是 (选填序号)
A.盐析、过滤 B.减压蒸馏、结晶
C.分液、过滤 D.常压蒸馏、萃取
(4)为测定产品中活性氧的含量(活性氧16%,相当于H2O234%),称取干燥样品2.000g,溶解,在250mL容量瓶中定容。准确量取25.00mL于锥形瓶中,加入1mL 6mol·L-1的硫酸,然后用0.1000mol·L-1 KMnO4标准溶液滴定,至滴入最后一滴时,溶液显浅红色且半分钟内不褪色,三次滴定平均消耗KMnO4溶液8.00mL(KMnO4溶液与尿素不反应)。
①完成并配平方程式: MnO4-+ H2O2+ H+= MnO2++ H2O+
②若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量 。(“偏高”、“偏低”或“不变”)。
③根据滴定结果,可确定产品中活性氧的质量分数为 。
过氧化尿素是一种无毒无味的白色粉末,是一种新型的漂白剂与消毒剂。它的合成方式如下:
请回答下列问题:
(1)根据反应原理,CO(NH2)2·H2O2分子内存在的作用力
是 。
A.共价键 B.离子键
C.金属键 D.氢键
(2)流程图中反应器的装置如图所示,推测该反应的加热方式是 ;回流管中冷水流从 口流入;搅拌器选用的材质是玻璃而不是铁质或铝质材料的原因是 。
(3)母液处理方案1可以是 (用文字表达)。若欲从母液中离出H2O2和尿素,可采用的操作是 (选填序号)
A.盐析、过滤 B.减压蒸馏、结晶
C.分液、过滤 D.常压蒸馏、萃取
(4)为测定产品中活性氧的含量(活性氧16%,相当于H2O234%),称取干燥样品2.000g,溶解,在250mL容量瓶中定容。准确量取25.00mL于锥形瓶中,加入1mL 6mol·L-1的硫酸,然后用0.1000mol·L-1 KMnO4标准溶液滴定,至滴入最后一滴时,溶液显浅红色且半分钟内不褪色,三次滴定平均消耗KMnO4溶液8.00mL(KMnO4溶液与尿素不反应)。
①完成并配平方程式: MnO4-+ H2O2+ H+= MnO2++ H2O+
②若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量 。(“偏高”、“偏低”或“不变”)。
③根据滴定结果,可确定产品中活性氧的质量分数为 。
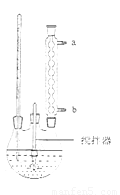
硫酸铜是一种应用极其广泛的化工原料。铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1、2所示)

(1)图1烧瓶中发生的离子反应方程式为: 。
(2)图2是图1的改进装置,其优点有: 。
(3)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
方案1:以空气为氧化剂。将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加FeSO4或Fe2(SO4)2,即发生反应。反应完全后向其中加物质甲调节pH到3~4,产生Fe(OH)3沉淀,过滤、蒸发、结晶,滤渣作催化剂循环使用。
(已知Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为3.7、6.4。)
请回答下列问题:①方案中的B仪器名称是 。
②方案2中甲物质是 (填字母序号)。
a.CaO b.CuCO3 c.CaCO3
第二组:过氧化氢为氧化剂法
将3.2g铜丝放到45ml 1.5mol?L―1的稀硫酸中,控温在50℃。加入18mL 10%的H2O2,反应0.5h后,升温到60℃,持续反应1h后,过滤、蒸发结晶、减压抽滤等,用少量95%的酒精淋洗后晾干,得到CuSO4?5H2O的质量为10.6g。
请回答下列问题:
③加热时温度不宜过高的原因是 ,根据有关数据计算出制取CuSO4?5H2O的产率(实际产量与理论产量的百分比)= 。
硫酸铜是一种应用极其广泛的化工原料.铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发.结晶得到硫酸铜晶体(装置如图1、2所示).

(1)图1中A仪器的名称________,烧瓶中发生的离子反应方程式为:________
(2)图2是图1的改进装置,其优点有:
①________________;②________________.
(3)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
方案1:以空气为氧化剂.将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应.
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应.向反应液中加FeSO4或Fe2(SO4)3,即发生反应.反应完全后向其中加物质甲调节pH到3~4,产生Fe(OH)3沉淀,过滤、蒸发、结晶,滤渣作催化剂循环使用.(已知Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为3、7、6、4.)
请回答下列问题:
①方案1中的B仪器名称是________.
②方案2中甲物质是________(填字母序号).
a.CaO b.CuCO3 c.CaCO3 d.NH3·H2O
第二组:过氧化氢为氧化剂法
将3.2 g铜丝放到45 mL 1.5 mol/L的稀硫酸中,控温在50℃.加入18 mL 10%的H2O2,反应0.5小时后,升温到60℃,持续反应1小时后,过滤、蒸发结晶、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O 10.6 g.
请回答下列问题:
③加热时温度不宜过高的原因是________________,晶体采用酒精淋洗的优点是________________.
④上述两种氧化法中,更符合绿色化学理念的是________(填“第一组”或“第二组”),理由是_________、_________、_________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com