
题目列表(包括答案和解析)
测定食醋的总酸度.食醋中除醋酸(CH3COOH)外,还含有少量其他有机酸.食醋的总酸度以每1000 ml食醋中含醋酸(其他酸也折算作醋酸)的质量(g)表示,通常写作CH3COOH%.用移液管移取市售食醋50.00 ml,置于250 ml容量瓶中,用水稀释至刻度,再从中移取25.00ml,用上小题已知浓度的NaOH溶液滴定,消耗碱液体积为V ml.写出CH3COOH%的计算式.
测定食醋的总酸度.食醋中除醋酸(CH3COOH)外,还含有少量其他有机酸.食醋的总酸度以每1000 ml食醋中含醋酸(其他酸也折算作醋酸)的质量(g)表示,通常写作CH3COOH%.用移液管移取市售食醋50.00 ml,置于250 ml容量瓶中,用水稀释至刻度,再从中移取25.00 ml,用上小题已知浓度的NaOH溶液滴定,消耗碱液体积为V ml.写出CH3COOH%的计算式.
Ⅰ.某化学实验小组探究市售食用白醋中醋酸的准确浓度,取25.00mL某品牌食用白醋于烧杯中,稀释并转移至250mL容量瓶中,定容,摇匀。取稀释液25.00mL用浓度为cb mol/L的标准NaOH溶液对其进行滴定。
(1)该小组用酚酞试液作指示剂,判断到达滴定终点的实验现象是: 。
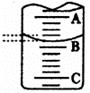
(2)右图表示50mL滴定管中液面的位置,若A与C刻度间相差l mL,A处的刻度为25,滴定管中液面读数应为 mL。
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为25.00mL,NaOH标准液浓度为cb mo1/L,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.32 | 25.34 | 25.30 |
| A.滴定前滴定管尖嘴有气泡,滴定结束无气泡 |
| B.盛装标准液的滴定管装液前用蒸馏水洗后,未用标准液润洗 |
| C.第一次滴定用的锥形瓶用白醋润洗 |
D.该NaOH标准液保存时间过长,有部分变质,浓 度降低 度降低 |
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.32 | 25.34 | 25.30 |
| A.滴定前滴定管尖嘴有气泡,滴定结束无气泡 |
| B.盛装标准液的滴定管装液前用蒸馏水洗后,未用标准液润洗 |
| C.第一次滴定用的锥形瓶用白醋润洗 |
D.该NaOH标准液保存时间过长,有部分变质,浓 度降低 度降低 |
 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的酸度(酸度单位:g/100ml),现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的酸度(酸度单位:g/100ml),现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围 (PH) |
5.0-8.0 | 3.1-4.4 | 4.4-6.2 | 8.2-10.0 |
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/ml | 26.02 | 25.32 | 25.28 |
| 151.8C |
| V |
| 151.8C |
| V |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com