
题目列表(包括答案和解析)
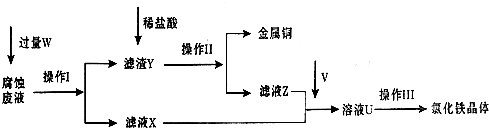
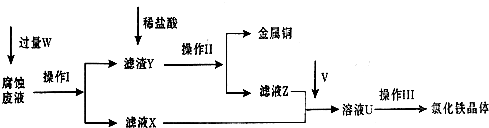
| ||
| ||
将高碘酸H5IO6加入MnSO4溶液中可使溶液呈紫红色,已知H5IO6在反应中发生如下过程:H5IO6→HIO3。完成下列填空:
(1)将该反应的氧化剂、还原剂及配平后的系数填入正确位置。
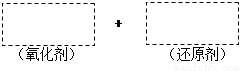
(2)在上图中标明电子转移的方向和数目。
(3)若向H5IO6溶液中加入足量的下列物质,能将碘元素还原成碘离子的是____(选填序号)。
a. 盐酸 b. 硫化氢 c. 溴化钠 d. 硫酸亚铁
(4)若向含1mol H5IO6 的溶液中加入过量的过氧化氢溶液,再加入淀粉溶液,溶液变蓝,同时有大量气体产生。请写出此反应的化学方程式:________________________________,此过程中至少可得到气体_________L(标准状态下)。
将高碘酸H5IO6加入MnSO4溶液中可使溶液呈紫红色,已知H5IO6在反应中发生如下过程:H5IO6→HIO3。完成下列填空:
(1)将该反应的氧化剂、还原剂及配平后的系数填入正确位置。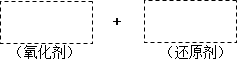
(2)在上图中标明电子转移的方向和数目。
(3)若向H5IO6溶液中加入足量的下列物质,能将碘元素还原成碘离子的是____(选填序号)。
a. 盐酸 b. 硫化氢 c. 溴化钠 d. 硫酸亚铁
(4)若向含1mol H5IO6的溶液中加入过量的过氧化氢溶液,再加入淀粉溶液,溶液变蓝,同时有大量气体产生。请写出此反应的化学方程式:________________________________,此过程中至少可得到气体_________L(标准状态下)。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com