
题目列表(包括答案和解析)
|
对于相同体积、相同 pH的烧碱溶液和氨水,下列叙述中正确的是 | |
| [ ] | |
A. |
两溶液的物质的量浓度相同 |
B. |
用相同浓度的盐酸中和时,消耗盐酸的体积相同 |
C. |
温度升高 10℃,两溶液的pH仍相等 |
D. |
两溶液中 OH-浓度相同 |
许多化学反应在溶液中进行,下面的问题均与溶液或溶液中的反应有关.
(1)某雨水样品刚采集时测得pH为4.82,放在烧杯中经2小时后,再次测得pH为4.68.以下叙述正确的是
[ ]
A.雨水样品酸度逐渐减小
B.雨水样品酸度没有变化
C.雨水样品继续吸收空气中的
D.雨水样品中的 逐渐被空气中的氧气氧化成
逐渐被空气中的氧气氧化成
(2)重金属离子有毒性.实验室有甲、乙两种废液,均有一定毒性.甲废液经化验呈碱性,主要有毒离子为 离子,如将甲、乙两废液按一定比例混合,毒性明显降低,乙废液中可能含有的离子是
离子,如将甲、乙两废液按一定比例混合,毒性明显降低,乙废液中可能含有的离子是
[ ]
 和
和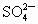
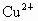 和
和
 和
和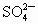
 和
和
(3)某制药厂尾气中含少量 气体,一般用NaOH溶液或氨水吸收,以防污染环境.分别用0.1mol/L的NaOH溶液或同浓度的氨水处理相同量的尾气,两种方法所需吸收液的体积关系是
气体,一般用NaOH溶液或氨水吸收,以防污染环境.分别用0.1mol/L的NaOH溶液或同浓度的氨水处理相同量的尾气,两种方法所需吸收液的体积关系是
[ ]
A.NaOH溶液的体积大于氨水
B.NaOH溶液的体积等于氨水
C.NaOH溶液的体积小于氨水
D.无法判断
(4)金属加工后的废切削液中含2%~5%的![]() ,它是一种环境污染物.人们用
,它是一种环境污染物.人们用 溶液来处理此废切削液,使
溶液来处理此废切削液,使 转化为无毒物质.该反应分两步进行:
转化为无毒物质.该反应分两步进行:
第一步:
第二步:
下列对第二步反应的叙述中正确的是
[ ]
①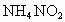 是氧化剂 ②
是氧化剂 ②![]() 是还原剂 ③
是还原剂 ③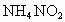 发生了分解反应 ④只有氮元素的化合价发生了变化 ⑤
发生了分解反应 ④只有氮元素的化合价发生了变化 ⑤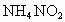 既是氧化剂又是还原剂
既是氧化剂又是还原剂
许多化学反应在溶液中进行,下面的问题均与溶液或溶液中的反应有关.
(1)某雨水样品刚采集时测得pH为4.82,放在烧杯中经2小时后,再次测得pH为4.68.以下叙述正确的是
[ ]
A.雨水样品酸度逐渐减小
B.雨水样品酸度没有变化
C.雨水样品继续吸收空气中的
D.雨水样品中的 逐渐被空气中的氧气氧化成
逐渐被空气中的氧气氧化成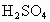
(2)重金属离子有毒性.实验室有甲、乙两种废液,均有一定毒性.甲废液经化验呈碱性,主要有毒离子为 离子,如将甲、乙两废液按一定比例混合,毒性明显降低,乙废液中可能含有的离子是
离子,如将甲、乙两废液按一定比例混合,毒性明显降低,乙废液中可能含有的离子是
[ ]
 和
和
 和
和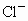
 和
和
 和
和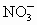
(3)某制药厂尾气中含少量 气体,一般用NaOH溶液或氨水吸收,以防污染环境.分别用0.1mol/L的NaOH溶液或同浓度的氨水处理相同量的尾气,两种方法所需吸收液的体积关系是
气体,一般用NaOH溶液或氨水吸收,以防污染环境.分别用0.1mol/L的NaOH溶液或同浓度的氨水处理相同量的尾气,两种方法所需吸收液的体积关系是
[ ]
A.NaOH溶液的体积大于氨水
B.NaOH溶液的体积等于氨水
C.NaOH溶液的体积小于氨水
D.无法判断
(4)金属加工后的废切削液中含2%~5%的![]() ,它是一种环境污染物.人们用
,它是一种环境污染物.人们用 溶液来处理此废切削液,使
溶液来处理此废切削液,使 转化为无毒物质.该反应分两步进行:
转化为无毒物质.该反应分两步进行:
第一步:
第二步:
下列对第二步反应的叙述中正确的是
[ ]
① 是氧化剂 ②
是氧化剂 ②![]() 是还原剂 ③
是还原剂 ③ 发生了分解反应 ④只有氮元素的化合价发生了变化 ⑤
发生了分解反应 ④只有氮元素的化合价发生了变化 ⑤ 既是氧化剂又是还原剂
既是氧化剂又是还原剂
废旧物的回收利用既有利于节约资源,又有利于保护环境。某研究小组同学以废旧锌锰干电池为原料,将废旧电池含锌部分转化成ZnSO4·7H2O,含锰部分转化成纯度较高的MnO2,将NH4Cl溶液应用于化肥生产中,实验流程如下:

(1)操作②中所用的加热仪器应选 (选填“蒸发皿”或“坩埚”)。
(2)将溶液A处理的第一步是加入氨水调节pH为9,使其中的Fe3+和Zn2+沉淀,请写出氨水和Fe3+反应的离子方程式 。
(3)操作⑤是为了除去溶液中的Zn2+。已知25℃时,
|
NH3·H2O的Kb |
Zn2+完全沉淀的pH |
Zn(OH)2溶于碱的pH |
|
1.8×10-5 |
8.9 |
>11 |
由上表数据分析应调节溶液pH最好为 (填序号)。
a.9 b.10 c.11
(4) MnO2精处理的主要步骤:
步骤1:用3%H2O2和6.0mol/L的H2SO4的混和液将粗MnO2溶解,加热除去过量H2O2,得MnSO4溶液(含少量Fe3+)。反应生成MnSO4的离子方程式为 ;
步骤2:冷却至室温,滴加10%氨水调节pH为6,使Fe3+沉淀完全,再加活性炭搅拌,抽滤。加活性炭的作用是 ;
步骤3:向滤液中滴加0.5mol/L的Na2CO3溶液,调节pH至7,滤出沉淀、洗涤、干燥,灼烧至黑褐色,生成MnO2。灼烧过程中反应的化学方程式为 。
(5) 查文献可知,粗MnO2的溶解还可以用盐酸或者硝酸浸泡,然后制取MnCO3固体。
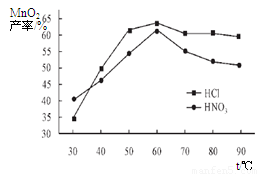
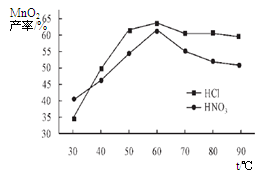
①在盐酸和硝酸溶液的浓度均为5mol/L、体积相等和最佳浸泡时间下,浸泡温度对MnCO3产率的影响如图4,由图看出两种酸的最佳浸泡温度都在 ℃左右;
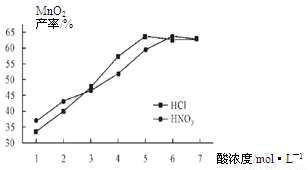
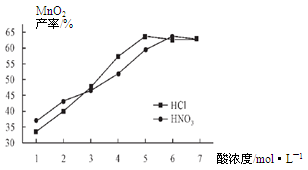
②在最佳温度、最佳浸泡时间和体积相等下,酸的浓度对MnCO3产率的影响如图5,由图看出硝酸的最佳浓度应选择 mol/L左右。
废旧物的回收利用既有利于节约资源,又有利于保护环境。某研究小组同学以废旧锌锰干电池为原料,将废旧电池含锌部分转化成ZnSO4·7H2O,含锰部分转化成纯度较高的MnO2,将NH4Cl溶液应用于化肥生产中,实验流程如下: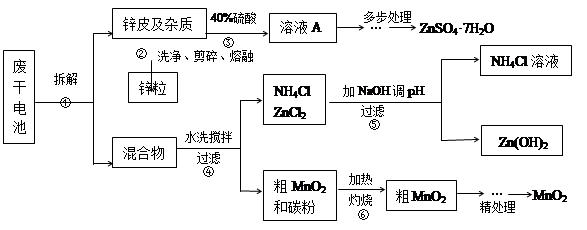
(1)操作②中所用的加热仪器应选 (选填“蒸发皿”或“坩埚”)。
(2)将溶液A处理的第一步是加入氨水调节pH为9,使其中的Fe3+和Zn2+沉淀,请写出氨水和Fe3+反应的离子方程式 。
(3)操作⑤是为了除去溶液中的Zn2+。已知25℃时,
| NH3·H2O的Kb | Zn2+完全沉淀的pH | Zn(OH)2溶于碱的pH |
| 1.8×10-5 | 8.9 | >11 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com