
题目列表(包括答案和解析)
已知![]() ,
,![]()
![]() .将20 mLNO和30 mL
.将20 mLNO和30 mL![]() 混合气体缓慢通入足量NaOH溶液后,最后剩余的气体体积最少是( )
混合气体缓慢通入足量NaOH溶液后,最后剩余的气体体积最少是( )
A.30 mL
B.10 mL
O.3.33 mL
D.0 mL
A.30 mL
B.10 mL
O.3.33 mL
D.0 mL
| A、将水沿着烧杯内壁缓缓加入浓硫酸中,用玻璃棒不断搅拌 | B、将20gKNO3完全溶于80 mL水中,配制质量分数约为20%的KNO3溶液 | C、用广泛pH试纸测得某溶液的pH为3.3 | D、分液时,将下层液体和上层液体先后从分液漏斗的下口放出 |
| ||
| ||
 HCO3-+OH-
HCO3-+OH- HCO3-+OH-
HCO3-+OH- C2D4(g);△H<0.在恒温恒容条件下,将一定量CD2和C2D4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
C2D4(g);△H<0.在恒温恒容条件下,将一定量CD2和C2D4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
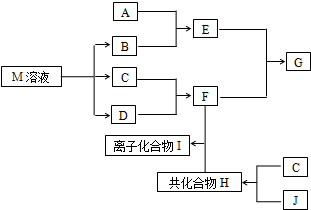 短周期元素的单质C、D、J在通常状况下均为气态,且常见双原子单质分子,J分子共价键最多;H分子中含10个电子;物质M由同一短周期的X、Y两种元素组成,X原子最外层电子数是最内层电子数的1/2,Y元素最高正价与它的负价代数和为6.M与其它物质的转化关系如图(部分产物及反应条件已略去)则:
短周期元素的单质C、D、J在通常状况下均为气态,且常见双原子单质分子,J分子共价键最多;H分子中含10个电子;物质M由同一短周期的X、Y两种元素组成,X原子最外层电子数是最内层电子数的1/2,Y元素最高正价与它的负价代数和为6.M与其它物质的转化关系如图(部分产物及反应条件已略去)则: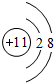
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com