(1)在25℃、101kPa下,1g甲烷燃烧生成CO
2和液态水时放热55.6kJ.则表示甲烷燃烧热的热化学方程式为
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6kJ/mol
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6kJ/mol
.
(2)下表中的数据表示破坏1mol化学键需消耗的能量(即键能,单位为kJ?mol
-1):
| 化学键 |
C-H |
C-F |
H-F |
F-F |
| 键能 |
414 |
489 |
565 |
158 |
根据键能数据计算以下反应的反应热△H:
CH
4(g)+4F
2(g)=CF
4(g)+4HF(g)△H=
-1928kJ?mol-1
-1928kJ?mol-1
.
(3)下列说法正确的是(填序号)
ABD
ABD
:
A.相同温度下,0.1mol?L
-1NH
4Cl溶液中NH
4+的浓度比0.1mol?L
-1氨水中NH
4+的浓度大;
B.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小;
C.电解饱和食盐水时,阳极得到氢氧化钠溶液和氢气;
D.对于Al(OH)
3(s)?Al(OH)
3(aq)?Al
3+(aq)+3OH
-(aq),前段为溶解平衡,后段是电离平衡;
E.除去溶液中的Mg
2+,用OH
-沉淀Mg
2+比用CO
32-效果好,说明Mg(OH)
2的溶解度比MgCO
3的大.

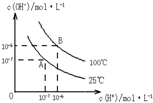 在水的电离平衡中,c(H+)和c(OH-)的关系如图所示:
在水的电离平衡中,c(H+)和c(OH-)的关系如图所示: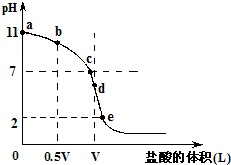 常温,向浓度为0.1mol/L,体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应.根据图象回答下列问题:
常温,向浓度为0.1mol/L,体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应.根据图象回答下列问题: