
题目列表(包括答案和解析)
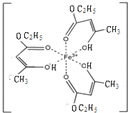 Ⅰ.氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如右图所示.
Ⅰ.氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如右图所示.| A-B | A=B | C-B | C=B | |
| 键能/kJ?mol-1 | 360 | 803 | 464 | 640 |
 第四周期的Cr、Fe、Co、Ni、Cu、Zn等许多金属能形成配合物.
第四周期的Cr、Fe、Co、Ni、Cu、Zn等许多金属能形成配合物.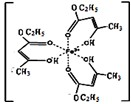 不锈钢以其优异的抗腐蚀性能越来越受到人们的青睐,它主要是由铁、铬、镍、铜、碳等元素所组成的合金.
不锈钢以其优异的抗腐蚀性能越来越受到人们的青睐,它主要是由铁、铬、镍、铜、碳等元素所组成的合金.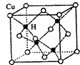 所示,若CuH的密度为d g/cm3,阿伏加德罗常数的值为NA,则该晶胞的边长为
所示,若CuH的密度为d g/cm3,阿伏加德罗常数的值为NA,则该晶胞的边长为 原子序数小于36的x、Y、z、w四种元素,元素x的原子核外最外层电子数是内层电子数的2倍,元素Y与x同周期,其基态原子占据s轨道的电子数与占据p轨道的电子数相同,z是x的同族相邻元素;w是第Ⅷ族元素中原子序数最小的元素.用元素符号回答下列问题:
原子序数小于36的x、Y、z、w四种元素,元素x的原子核外最外层电子数是内层电子数的2倍,元素Y与x同周期,其基态原子占据s轨道的电子数与占据p轨道的电子数相同,z是x的同族相邻元素;w是第Ⅷ族元素中原子序数最小的元素.用元素符号回答下列问题:


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com