
题目列表(包括答案和解析)
元素周期表第二周期Li到Ne原子的电离势总的趋势是怎样变化的
A 从大变小
B 从小变大
C 从Li到N逐渐增加,从N到Ne逐渐下降
D 没有多大变化
元素周期表是学习物质结构和性质的重要工具,元素周期律反映了元素性质的周期性变化规律。
(1)元素A的原子最外层电子排布式为nsnnpn,该原子最外层共有 种不同运动状态的电子,该原子核外共有 种能量不同的电子。元素A与氢元素形成的分子,其空间结构可能是(填序号) 。
(2)下列变化规律中正确的是 。
A.金属K、Na、Mg的熔沸点由低到高
B.C1-、Br-、I-的失电子能力由弱到强
C.H+、Li+、H-的半径由大到小
D.H3PO4、HClO4、H2SO4的酸性由弱到强
(3)第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如下表所示,其中A的电子式为 ,E的化学式为 。
| 氢化物 | A | B | HF | D | E |
| 沸点/℃ | 1317 | 100 | 19.5 | 33 | 164 |
元素周期表是学习物质结构和性质的重要工具,元素周期律反映了元素性质的周期性变化规律。
(1)元素A的原子最外层电子排布式为nsnnpn,该原子最外层共有 种不同运动状态的电子,该原子核外共有 种能量不同的电子。元素A与氢元素形成的分子,其空间结构可能是(填序号) 。
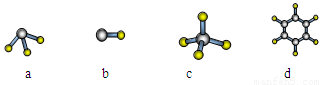
(2)下列变化规律中正确的是 。
A.金属K、Na、Mg的熔沸点由低到高
B.C1-、Br-、I-的失电子能力由弱到强
C.H+、Li+、H-的半径由大到小
D.H3PO4、HClO4、H2SO4的酸性由弱到强
(3)第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如下表所示,其中A的电子式为 ,E的化学式为 。
|
氢化物 |
A |
B |
HF |
D |
E |
|
沸点/℃ |
1317 |
100 |
19.5 |
33 |
164 |
元素周期表是学习物质结构和性质的重要工具,元素周期律反映了元素性质的周期性变化规律。
(1)元素A的原子最外层电子排布式为nsnnpn,该原子最外层共有 种不同运动状态的电子,该原子核外共有 种能量不同的电子。元素A与氢元素形成的分子,其空间结构可能是(填序号) 。
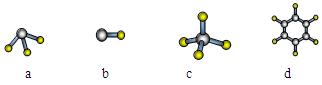
(2)下列变化规律中正确的是 。
A.金属K、Na、Mg的熔沸点由低到高
B.C1-、Br-、I-的失电子能力由弱到强
C.H+、Li+、H-的半径由大到小
D.H3PO4、HClO4、H2SO4的酸性由弱到强
(3)第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如下表所示,其中A的电子式为 ,E的化学式为 。
| 氢化物 | A | B | HF | D | E |
| 沸点/℃ | 1317 | 100 | 19.5 |
|
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com