为测定含有Na
2O杂质的Na
2O
2样品的纯度,甲、乙、丙三位同学设计了不同的方案.
甲:用图l所示装置,通过测定Na
2O
2与C0
2反应生成0
2的体积来测定样品的纯度.
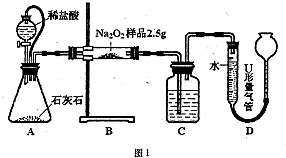
(1)C中所盛的药品是
NaOH溶液
NaOH溶液
(2)A中橡皮管的作用是
起恒压作用,使盐酸容易滴下;避免盐酸排空气使氧气体积偏大
起恒压作用,使盐酸容易滴下;避免盐酸排空气使氧气体积偏大
(3)利用该实验方案所测Na
2O
2的纯度明显偏大,其原因可能是
ac
ac
(填选项字母).
a.装置A、B中的空气对测定结果产生了影响
b.装置C中的空气对测定结果产生了影响
c.读数时U形量气管中的液面左高右低
d.读数时U形量气管中的液面左低右高
乙、丙两同学在研究Na
2O
2与水反应的实验时,观察到以下实验现象:Na
2O
2与水反应,放出大量的热,产生大量气体;反应后的溶液中滴入几滴酚酞,溶液先变红,振荡后又褪色;再往溶液中加入少许Mn0
2:粉末,又产生大量气体;当不再产生气体时,再滴加几滴酚酞,溶液又变红,且振荡后不褪色.分析了这些实验现象后,他们分别设计了如下方案.
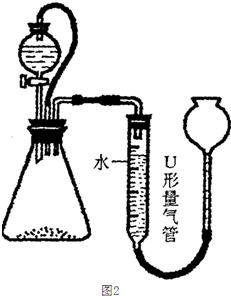
乙:用图2所示装置,称取2.5g样品,测得与水反应生成氧气的体积为112mL(标准状况),然后将溶液先用硫酸中和,再用0.2mol/L KMn0
4酸性溶液滴定,消耗KMn0
4酸性溶液30mL(已知:滴定过程中生成了Mn
2+和氧气).
(4)滴定过程中发生反应的离子方程式为
2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O
2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O
(5)滴定终点的颜色变化为
溶液由无色变紫红色
溶液由无色变紫红色
(6)计算Na
2O
2样品的纯度是:
| (0.2×0.03×+×2)mol×78g/mol |
| 2.5g |
×100%=78%
| (0.2×0.03×+×2)mol×78g/mol |
| 2.5g |
×100%=78%
.


