
题目列表(包括答案和解析)
已知:P4(s、白磷)+5O2(g) == P4O10(s);△H=-2983.2kJ·mol-1;P(s、红磷)+ 5/4O2(g) == 1/4P4O10(s);△H=-738.5kJ·mol-1那么,1 mol白磷转变成相应物质量的红磷时,应是:
A.放出29.2kJ热量; B.吸收29.2kJ热量;
C.放出2244.7kJ热量; D.吸收2244.7kJ热量。
(1)已知:P4(白磷,s)+5O2(g)=P4O10(s) ΔH=-2983.2kJ/mol
P(红磷,s)+5/4O2(g)=1/4 P4O10(s) ΔH=-738.5kJ/mol
则白磷转化为红磷的热化学方程式为 ;由此说明红磷的稳定性比白磷 。
(2)明矾[KAl(SO4)2·12H2O]水溶液呈 (填“酸”、“碱”或“中”)性;明矾还能净水,用离子方程式解释其原因为 。
(3)电解池的能量转化形式为 ,原电池反应 (填“一定”或“不一定”)自发。
(4)pH=3的盐酸和pH=3的醋酸溶液各稀释至其体积的100倍,稀释后盐酸的pH (填“大于”、“小于”或“等于”)醋酸的pH;常温时pH=x的盐酸和pH=y的NaOH溶液以1︰10的体积比混合,反应后溶液恰好呈中性,则x、y满足的关系是 。
同素异形体相互转化的反应热相当小而且转化速度较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的观点“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”来研究。已知:
①P4(s、白磷)+5O2(g)=P4O10(s);Δ H=-2983.2 KJ·mol-1
②P(s、红磷)+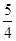 O2(g)=
O2(g)=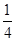 P4O10(s);Δ H=-738.5KJ·mol-1
P4O10(s);Δ H=-738.5KJ·mol-1
试写出白磷转化为红磷的热化学方程式
| 5 |
| 4 |
| 1 |
| 4 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com