
题目列表(包括答案和解析)
 在2L密闭容器中反应2NO2(g)
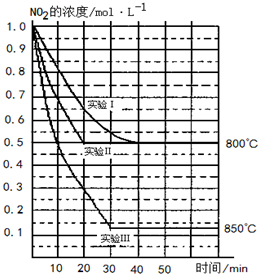
在2L密闭容器中反应2NO2(g)  2NO(g)+O2(g)在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度(mol?L-1)随时间(min)的变化如图所示.请回答下列问题:
2NO(g)+O2(g)在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度(mol?L-1)随时间(min)的变化如图所示.请回答下列问题:
 2NO(g)+O2(g)在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度随时间(min)的变化如图所示.请回答下列问题:
2NO(g)+O2(g)在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度随时间(min)的变化如图所示.请回答下列问题: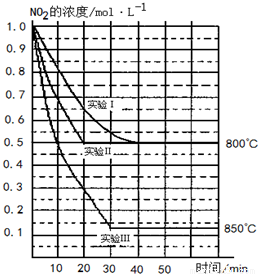
(1)在容积为3L的密闭容器中盛有N2和H2,在一定条件下发生反应,经过5min后达到化学平衡,此时容器中含有0.9 mol N2,1.2 mol H2,3 mol NH3,则H2起始浓度为________,H2的转化率________用H2表示的反应速率![]() =________,平衡时混合气体的平均相对分子质量为________.
=________,平衡时混合气体的平均相对分子质量为________.
(2)有可逆反应A(g)+B(g)![]() 3C(g),下图分别表示在不同条件下,生成物C在反应混合物中的百分含量(C%)和反应时间(t)的关系图
3C(g),下图分别表示在不同条件下,生成物C在反应混合物中的百分含量(C%)和反应时间(t)的关系图
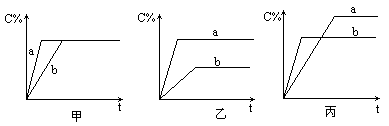
按下述要求填空写答案①甲图中两条曲线分别表示有无催化剂时的情况,则________曲线表示无催化剂;②若乙图曲线a表示200℃和b表示100℃的情况,则该可逆反应的正反应是________热反应;③若丙图中两条曲线分别表示不同压强下的情况,则________曲线是表示压强较大时的情况.
(3)将V mL NO和NO2的混合气通过水吸收后,得到a mL无色气体A,将此无色气体A与等体积O2混合,再通过水充分吸收后,收集到5 mL无色气体B,试回答:
①A气体是________,B气体是________
②A气体的体积是________ mL
③V的取值范围是________
(8分)(2011·扬州调研)在2 L密闭容器中反应2NO2(g) 2NO(g)+O2(g)在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度(mol·L-1)随时间(min)的变化如图所示。请回答下列问题:
(1)对比实验Ⅰ、Ⅱ和Ⅲ,得出的下列结论中正确的是( )
A.实验Ⅱ和实验Ⅰ相比,可能隐含的反应条件是:反应容器的体积缩小了
B.实验Ⅱ和实验Ⅰ相比,可能隐含的反应条件是:使用效率更高的催化剂
C.实验Ⅰ条件下该反应的平衡常数大于实验Ⅲ条件下该反应的平衡常数
D.对比实验Ⅰ和Ⅲ可知,该反应是吸热反应
(2)若实验Ⅰ中NO2的起始浓度改为1.2mol·L-1,其他条件不变,则达到平衡时所需用的时间________40 min(填“大于”、“等于”或“小于”),NO2的转化率将________(填“增大”、“减小”或“不变”)。
(3)若实验Ⅰ中达平衡后,再向密闭容器中通入2 mol由物质的量之比为1∶1组成的NO2与NO混合气体(保持温度不变),则平衡将________移动,新平衡状态时NO2的物质的量浓度为________mol·L-1。
(4)若将实验Ⅲ所得的平衡混合气体通入足量的水中,欲使气体被完全吸收则至少应同时通入标准状况下的空气________L。(设空气中N2与O2体积比4∶1)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com