
题目列表(包括答案和解析)

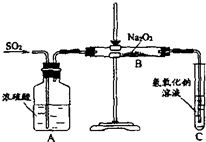
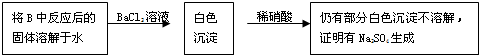
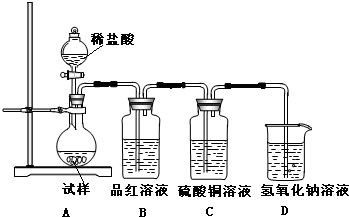 为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和图所示的实验装置进行实验.请回答下列有关问题:
为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和图所示的实验装置进行实验.请回答下列有关问题:
| ||
| ||
下表中的实验操作能达到实验目的或能得出相应结论的是
选项????????????? 实验操作????????????? 实验目的或结论
A????????????? 向盛有1mL 0.01mol·L-1AgNO3溶液的试管中滴加5滴0.01mol·L-1NaCl溶液,有白色沉淀生成,再向其中滴加 0.01mol·L-1NaI溶液,产生黄色沉淀。????????????? 常温下,
Ksp(AgCl)>Ksp(AgI)
B????????????? 取少量 KClO3晶体溶于适量的蒸馏水,再加入硝酸酸化的AgNO3溶液。????????????? 检验KClO3中的氯元素
C????????????? 向某溶液中滴加Ba(NO3)2溶液产生白色沉淀,再加稀盐酸沉淀消失。????????????? 说明原溶液中一定含有CO32- 或 SO32-
D????????????? 将混有Ca(OH)2杂质的Mg(OH)2样品,放入水中搅拌成浆状后,加入足量饱和氯化镁溶液充分搅拌、过滤,沉淀用蒸馏水洗涤。????????????? 除去Mg(OH)2样品中的Ca(OH)2
下表中的实验操作能达到实验目的或能得出相应结论的是
选项????????????? 实验操作????????????? 实验目的或结论
A????????????? 向盛有1mL 0.01mol·L-1AgNO3溶液的试管中滴加5滴0.01mol·L-1NaCl溶液,有白色沉淀生成,再向其中滴加 0.01mol·L-1NaI溶液,产生黄色沉淀。????????????? 常温下,
Ksp(AgCl)>Ksp(AgI)
B????????????? 取少量 KClO3晶体溶于适量的蒸馏水,再加入硝酸酸化的AgNO3溶液。????????????? 检验KClO3中的氯元素
C????????????? 向某溶液中滴加Ba(NO3)2溶液产生白色沉淀,再加稀盐酸沉淀消失。????????????? 说明原溶液中一定含有CO32- 或 SO32-
D????????????? 将混有Ca(OH)2杂质的Mg(OH)2样品,放入水中搅拌成浆状后,加入足量饱和氯化镁溶液充分搅拌、过滤,沉淀用蒸馏水洗涤。????????????? 除去Mg(OH)2样品中的Ca(OH)2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com