
题目列表(包括答案和解析)
| A、用盐酸可以洗去铜表面的铜锈 | B、0.1mol?L-1的CuSO4溶液中,Cu2+的数目一定小于0.1NA | C、在CuCl2和FeCl3的混合溶液中加入铁粉,若有固体残留,则其中一定含有铜 | D、在FeSO4溶液中加入CuS固体,溶液中c(Fe2+)不变,说明K甲(CuS)远小于K甲(FeS) |
下列离子方程式正确的是 ( )
A.漂白粉溶液在空气中的漂白原理:
Ca2++2ClO-+CO2+H2O===2HClO+CaCO3↓
B.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全Ba2++OH-+H++SO![]()
===BaSO4↓+H2O
C.用铁作电极电解饱和食盐水:
2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
D.FeSO4溶液中加H2O2溶液:
Fe2++2H2O2+4H+===Fe3++4H2O
Ⅰ 铁盐、亚铁盐是实验室常用的药品。
请根据题意,完成下列填空:
(1)向酸化的FeCl3溶液中逐滴加入KI溶液,溶液变成棕褐色。该反应的离子方程式为 。
(2)向酸化的FeSO4溶液中加几滴硫氰化钾溶液,没有什么明显变化,再滴加双氧水,溶液变红色。继续滴加双氧水,红色逐渐褪去,且有气泡产生。
写出上述变化中,有关反应的离子方程式:
①
②Fe3++3SCN-=Fe(SCN)3
③11H2O2+2SCN-=2SO42-+2CO2↑+N2↑+10H2O+2H+
若生成1mol N2,H2O2和SCN-的反应中转移电子的物质的量是 mol。
(3)根据以上实验,推断Fe2+、I-和SCN-的还原性由强到弱的顺序为 。
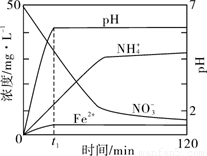
Ⅱ 某课题组利用Fe粉和KNO3溶液反应,模拟地下水脱氮过程,探究脱氮原理。
(4)实验前:①先用0.1 mol·L-1H2SO4洗涤Fe粉,其目的是 ,然后用蒸馏水洗涤至中性;②将KNO3溶液的pH调至2.5;③为防止空气中的O2对脱氮的影响,应向KNO3溶液通入 (写化学式)。
(5)如图表示足量Fe粉还原上述KNO3溶液过程中,测出的溶液中相关离子浓度、pH 随时间的变化关系(部分副反应产物曲线略去)。请根据图中信息写出t1时刻前该反应生成的阳离子分别是 、 。t1时刻后,该反应仍在进行,溶液中NH4+的浓度在增大,Fe2+的浓度却没有增大,可能的原因是 。
下列有关含铜化合物的说法错误的是(设NA为阿伏加德罗常数的值)
A.用盐酸可以洗去铜表面的铜锈
B.0.1mol/L的CuSO4溶液中,Cu2+的数目一定小于0.1NA
C.在CuCl2和FeCl3的混合溶液中加入铁粉,若有固体残留,则其中一定含有铜
D.在FeSO4溶液中加入CuS固体,溶液中c(Fe2+)不变,说明Ksp(CuS)远小于Ksp(FeS)
(1)在FeSO4溶液中滴加少量NaOH溶液,现象为__________________________,所发生反应的化学方程式为
____________________________________________________________________________。
(2)在MgCl2溶液中滴加少量NaOH溶液,现象为________________,继续加入过量的NaOH溶液,现象为________________。
(3)在AlCl3溶液中滴加少量NaOH溶液,现象为_______________,所发生反应的离子方程式为_________________________________,继续加入过量的NaOH溶液,现象为_______________,所发生反应的离子方程式为__________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com