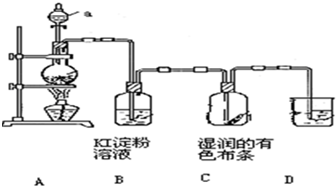
某化学研究性学习小组设计制取氯气及探究其性质的方案,并按下图所示装置完成实验.(A中发生反应的化学方程式为:MnO
2+4HCl(浓)═MnCl
2+
Cl
2↑+2H
2O).
(1)装置A中,仪器a的名称是
.
(2)装置B中无色溶液将变为
色,该反应的化学方程式是
.
(3)装置C中湿润的有色布条
(填“褪色”或“不褪色”),其原因是氯气与水反应生成了
(填化学式).
(4)为了吸收多余的氯气,防止造成空气污染,装置D中应盛放
溶液.
(5)用8.7g MnO
2与足量浓盐酸反应,被氧化的盐酸的物质的量为
.
(6)某同学查阅资料得知:高锰酸钾与浓盐酸在常温正好生反应也可以生成氯气(反应的化学方程式为:2KMnO
4+16HCl(浓)═2KCl+2MnCl
2+5Cl
2↑+8H
2O),该反应的氧化剂是
.
(7)如反应中转移了0.50mol电子,则产生的气体在标准状况下体积为
L.
(8)若氯气泄漏,某同学用湿毛巾捂住鼻子防止中毒,有以下四种溶液可浸湿毛巾,它们分别是:①NaOH溶液 ②NaCl溶液 ③KBr溶液 ④NaHCO
3溶液,正确选择是
(填序号).

 某化学研究性学习小组设计制取氯气及探究其性质的方案,并按下图所示装置完成实验.(A中发生反应的化学方程式为:MnO2+4HCl(浓)═MnCl2+
某化学研究性学习小组设计制取氯气及探究其性质的方案,并按下图所示装置完成实验.(A中发生反应的化学方程式为:MnO2+4HCl(浓)═MnCl2+