
题目列表(包括答案和解析)
A、B、C是三种常见短周期元素的单质。常温下D为无色液体,E是一种常见的温室气体,F是由两种短周期元素构成的离子化合物,其转化关系如图 (反应条件和部分产物略去)。试回答:
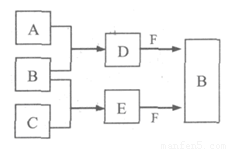
(1) F的电子式是 。
(2)写出E与F反应生成B的化学方程式,并用双线桥标出电子转移的方向与数目
(3) 单质X和B或D均能反应生成黑色固体Y,Y与盐酸反应的离子方程式是 。若固体恰好溶解,则所得溶液呈 性。
(4) 物质Z常用于对空气进行杀菌、净化和水果保鲜等。Z和B的组成元素相同,Z分子中各原子最外层电子数之和为18。Z和酸性碘化钾溶液反应生成B和碘单质,反应的离子方程式是 。
(5) 取0.3 mol F与足量D充分混合后,所得溶液中再通入0.4 mol E充分反应,最后得到产物的物质的量比为 。(不考虑水解)
(6) E的大量排放会引发很多环境问题。有科学家提出,用E和H2合成CH3OH和H2O,对E进行综合利用。25℃,101 kPa时,该反应的热化学方程式是 。
(已知甲醇的燃烧热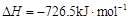 ,氢气的燃烧热
,氢气的燃烧热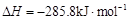 )
)
下列实验基本操作正确的是 ( )
A.用碱式滴定管量取0.10 mol·L-1的Na2CO3溶液22.10 mL;
B.配制一定浓度的氢氧化钠溶液时,将氢氧化钠固体放在纸片上称量
C.用广范PH试纸测某 溶液PH=3.6
D.用玻璃棒蘸取溶液滴到湿润的pH试纸上,测其PH
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04 mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.
A.K+一定存在 B.100 mL溶液中含0.01 mol ![]()
C.Cl-可能存在 D.Ba2+一定不存在,Mg2+可能存在
以下是加热过程中发生的化学反应:CuSO4·5H2O![]() CuSO4+5H2O↑
CuSO4+5H2O↑
CuSO4![]() CuO+SO3↑
CuO+SO3↑
4CuO![]() 2Cu2O+O2↑
2Cu2O+O2↑
2SO3![]() 2SO2+O2
2SO2+O2
(1)充分反应后,最终固体产物颜色为___________,其质量为___________g。
(2)在某中间温度时,固体产物质量能否为10 g? ___________ (填“能”或“不能”)。如可能,请计算其组成和质量,如不可能,请说明理由:_________________________________。
(3)如果某同学在做此实验时,最后得到固体质量为7.6 g,试计算该固体的组成和质量。
(4)不考虑实验带来的误差,在该反应条件下最终生成气态产物除去水后,物质的量可能为( )
A.0.10 mol B.0.15 mol C.0.20 mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com