为清楚地看到无色NO遇空气变为红棕色(或浅棕色)的过程.某化学兴趣小组的甲、乙两位同学分别设计如下两个实验:
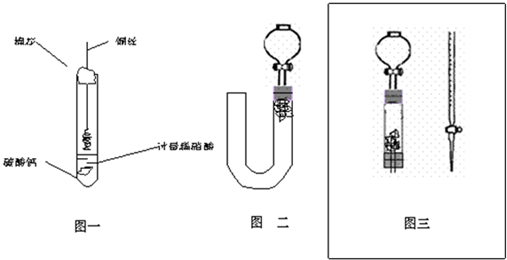
(1)甲同学实验如图一,步骤如下:①取大试管,放入适量大理石,加入过量稀硝酸②如图塞好疏松的棉花和铜丝③一段时间后,使铜丝浸入过量的硝酸反应④慢慢向试管底部推入棉花,可见明显现象.第①步放入大理石的作用是:
除去装置内的空气,防止生成的NO被氧化而影响实验效果
除去装置内的空气,防止生成的NO被氧化而影响实验效果
.
(2)乙同学则用图二装置,他的设想是这样:从分液漏斗注入稀硝酸,直到浸没铜丝,然后,关闭分液漏斗活塞,NO产生的压强将排开稀硝酸,达一定体积后,打开分液漏斗活塞,硝酸液体将NO气体压入空分液漏斗,在分液漏斗球部空间因接触空气而变色.但按他的方法实际操作的丙同学发现此法至少存在两个问题:
①当酸液加到浸没分液漏斗下端管口以后,会
因如图所示的铜丝所在空间中被封闭一段空气
因如图所示的铜丝所在空间中被封闭一段空气
而使后面的实验无法观察到预期现象.
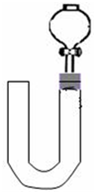
②反应开始后,因为随着NO的体积增加,
产生的NO排开酸液而与大部分铜丝脱离接触
产生的NO排开酸液而与大部分铜丝脱离接触
影响铜丝与硝酸的继续反应.
(3)丙同学将分液漏斗下端管口上提至与塞子下端齐平,解决了第①个问题,再用一个与U形管配套的单孔塞和另一个分液漏斗,仍用前述乙的仪器和思路,从左边顺利地将硝酸加到分液漏斗活塞处,请在图中补齐装置并特别画出铜丝的适当位置:
(4)丁同学根据丙的思路,认为可以测定一下NO的体积并计算其产率(不考虑有其它气体),如果给你图三所示的仪器及一个酸式滴定管,用一根橡胶皮管将它们连接起来.为成功量取产生NO的体积,此实验中注入的硝酸在滴定管中至少应到达
分液漏斗最大量程刻度处
分液漏斗最大量程刻度处
,设定有条件精确称量,还需要的数据是
铜丝反应前后的质量
铜丝反应前后的质量
.
(5)计算知:将等体积NO和O
2通入倒置于水槽中的盛满水的试管中,充分反应后剩余气体的体积为原气体总体积的1/8,但准确的实验表明:余气体积比计算结果要大,实事求是的科学精神,要求我们应认真思考.已知氢氧化钠溶液可以吸收NO
2,方程式为2NaOH+2NO
2═NaNO
2+NaNO
3+H
2O,氢氧化钠溶液可以吸收NO、NO
2的混合气体,方程式为2NaOH+NO
2+NO═2NaNO
2+H
2,能否受此启发,写出可能发生的反应方程式,并对上述情况作一合理的解释:



