
题目列表(包括答案和解析)
 晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下: Si+2CO↑.
Si+2CO↑. SiCl4.
SiCl4. Si+4HCl.
Si+4HCl. Si+2CO↑.
Si+2CO↑. SiCl4.
SiCl4. Si+4HCl.
Si+4HCl.
二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟用左下图所示装置模拟工业制取并收集ClO2。
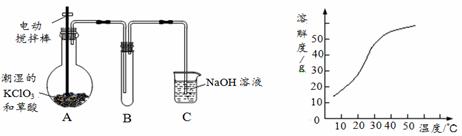
(1)A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式: 。
(2)A必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有烧杯、 ;B也必须添加温度控制装置,应该是 (选填“冰水浴”或“热水浴”)装置。
(3)反应后在装置C中可得NaClO2溶液。已知NaClO2饱和溶液中在温度低于38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2。根据右上图所示的NaClO2的溶解度曲线,请补充从NaClO2溶液中制得NaClO2的操作步骤:
① ;② ;③洗涤;④干燥。
(4)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100.00 mL试样;量取V1 mL试样加入到锥形瓶中;
步骤2:调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入淀粉指示剂,用c mol·L—1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知2 Na2S2O3 + I2 = Na2S4O6 + 2NaI)
①滴定过程中,至少须进行两次平行测定的原因是 。
②原ClO2溶液的浓度为 g / L(用步骤中的字母代数式表示)。
(15分)某校一研究性学习小组对胆矾晶体受热分解进行讨论。
Ⅰ.他们查阅资料得知:将胆矾晶体置于烘箱中加热时,在79~134℃,晶体失重14.4%;134~250℃,又失重14.4%;250~300℃,再失重7.2%。之后加热至620℃,质量维持不变。小组经过计算得出,胆矾在300~620℃的固体残留物为无水硫酸铜,134℃时的固体残留物的化学式为 。
Ⅱ.小组对无水硫酸铜继续升温加热的可能变化进行猜想。他们提出了产物的以下几种猜想:
①.CuO、SO3;。
②.CuO、SO2和O2;
③.CuO、SO3和SO2;
④.CuO、SO3、SO2和O2
小组经过激烈讨论,认为猜想③不用实验就可排除,他们的理由是
查阅资料:①SO3为无色晶体,熔点16.6℃,沸点44.8℃。
②SO2,熔点:-72.4℃,沸点:-10℃;SO2通入BaCl2溶液中,无明显现象。
Ⅲ.实验探究:
小组按下图所示安装好实验装置。
(1)安装好装置后,未装药品前必须进行的操作是 。
D装置的作用是 。
(2)按图示装好药品后,用酒精喷灯对着硬质试管加热。一会儿后,B中溶液产生白色浑浊,C中溶液逐渐褪色。
Ⅳ.实验结果分析:
(1)小组同学大多认为无水硫酸铜热分解产物应该为猜想④。但有一个同学提出质疑,他认为B中溶液产生白色浑浊并不一定能确定产物中含有SO3。他的依据涉及的化学方程式是 。于是,小组同学经讨论决定,再增加一个装置E,你认为该装置应加在 (填装置字母)之间。增加装置后,小组重新实验,证明了产物中确实存在SO3。你认为他们根据什么现象得到这一结论? 。
(2)小组在完成无水硫酸铜热分解的化学方程式时遇到了困难。他们发现该化学方程式为不定方程式,存在无数种配平情况,经过慎密地分析,他们认为只要能确定某些物质的计量数之比,即可确定该化学方程式。如已知SO2与SO3的计量数之比,就能确定该化学方程式。若设SO2与SO3的计量数之比为x,请写出配平后的化学方程式 。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com