
题目列表(包括答案和解析)
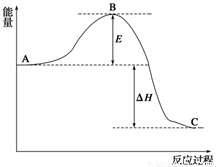
(14分)2SO2(g)+O2(g) 2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。
2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。
请回答下列问题:
(1)图中A、C分别表示__________、______________,E的大小对该反应的反应热有无影响?______________。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?____________;
(2)图中ΔH=__________kJ/mol;
(3)如果反应速率v(SO2)为0.05 mol/(L·min),则v(O2)=________mol/(L·min)
(4)已知单质硫的燃烧热为296 kJ/mol,计算由S(s)生成3 mol SO3(g)的ΔH=_ _ 。
(14分)2SO2(g)+O2(g) 2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。
2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。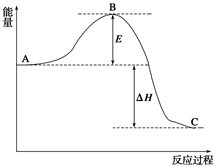
请回答下列问题:
(1)图中A、C分别表示__________、______________,E的大小对该反应的反应热有无影响?______________。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?____________;
(2)图中ΔH=__________kJ/mol;
(3)如果反应速率v(SO2)为0.05 mol/(L·min),则v(O2)=________mol/(L·min)
(4)已知单质硫的燃烧热为296 kJ/mol,计算由S(s)生成3 mol SO3(g)的ΔH=_ _。
 2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。
2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。
由黄铜矿为原料(主要成分为CuFeS2)制备99.95%~99.98%精铜的流程如下:

(1)高温焙烧第一反应为2CuFeS2+4O2![]() Cu2S+2FeO+3SO2,该反应中氧化剂为_________.产物Cu2S在1 200℃高温下继续反应:2Cu2S+3O2
Cu2S+2FeO+3SO2,该反应中氧化剂为_________.产物Cu2S在1 200℃高温下继续反应:2Cu2S+3O2![]() 2Cu2O+2SO2,2Cu2O+Cu2S
2Cu2O+2SO2,2Cu2O+Cu2S![]() 6Cu+SO2.6 mol CuFeS2和14.25 mol O2反应,理论上可得到Cu_________mol(假定各步反应都完全).
6Cu+SO2.6 mol CuFeS2和14.25 mol O2反应,理论上可得到Cu_________mol(假定各步反应都完全).
(2)取三份质量均为16.9 g的上述粗铜,成分为Cu、Fe、Zn.现在需要分析其中铜的含量,进行如下实验(所有气体体积均为标况下的数据):
①取一份粗铜放入足量稀硫酸中,共放出氢气1.568 L.
②另取一份粗铜放入稍过量的较浓硝酸中,加热使合金铜完全溶解,收集到了NO和NO2的混合气体8.736 L,与3.304 L O2混合后,得到的混合气体恰好被水完全吸收.
③再取一份粗铜进行电解精炼,阳极完全溶解后阴极增加质量17.28 g.
求粗铜中Cu的质量分数(保留一位小数).
| 物质 | 分子数 | 质量(g) | 物质的量(mol) | 标准状况下 气体体积 (L) |
| H2O | 3.01×1023 3.01×1023 |
9 9 |
0.5 | |
| HNO3 | 3.01×1022 | 3.15 3.15 |
0.05 0.05 | |
| N2 | 3.01×1023 3.01×1023 |
14 | 0.5 0.5 |
11.2 11.2 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com