
题目列表(包括答案和解析)
(16分)某同学利用下列装置实现铜与浓硝酸、稀硝酸反应,过程如下:
I.取一段铜丝,用稀硫酸除去铜锈[主要成分是Cu2(OH)2CO3]。
Ⅱ.将洗涤后的铜丝做成匝数较多的螺旋状。
III.按如图所示装置连接仪器、检查气密性、装入化学试剂。
(1)过程I发生反应的离子方程式是 。
(2)写出过程III中检查气密性的方法 。
⑶过程III的后续操作如下:
①打开止水夹a和b,轻推注射器,使浓硝酸与铜丝接触,观察到的现象是 ,一段时间后使反应停止的操作是 ,关闭a,取下注射器。
②打开b和分液漏斗活塞,当玻璃管充满稀硝酸后,关闭b和分液漏斗活塞,打开a,观察到有气泡产生。稀硝酸充满玻璃管的实验目是 ,该反应的离子方程式是 。
(4)另取3支盛满NO2气体的小试管分别倒置在盛有常温水、热水和冰水的3只烧杯中,发现液面上升的高度明显不一致。结果如下表所示(忽略温度对气体体积的影响):
①根据上表得出的结论是温度越 (填“高”或“低”),进入试管中的溶液越多。
②查阅资料:
a.NO2与水反应的实际过程为:2NO2+H2O=HNO3+HNO2 3HNO2 =HNO3+2NO+H2O;
b.HNO2不稳定。
则产生上述现象的原因是 。
(16分)某同学利用下列装置实现铜与浓硝酸、稀硝酸反应,过程如下:
I. 取一段铜丝,用稀硫酸除去铜锈[主要成分是Cu2(OH)2CO3]。
Ⅱ.将洗涤后的铜丝做成匝数较多的螺旋状。
III.按如图所示装置连接仪器、检查气密性、装入化学试剂。

(1)过程I发生反应的离子方程式是 。
(2)写出过程III中检查气密性的方法 。
⑶过程III的后续操作如下:
①打开止水夹a和b,轻推注射器,使浓硝酸与铜丝接触,观察到的现象是 ,一段时间后使反应停止的操作是 ,关闭a,取下注射器。
②打开b和分液漏斗活塞,当玻璃管充满稀硝酸后,关闭b和分液漏斗活塞,打开a,观察到有气泡产生。稀硝酸充满玻璃管的实验目是 ,该反应的离子方程式是 。
(4)另取3支盛满NO2气体的小试管分别倒置在盛有常温水、热水和冰水的3只烧杯中,发现液面上升的高度明显不一致。结果如下表所示(忽略温度对气体体积的影响):

①根据上表得出的结论是温度越 (填“高”或“低”),进入试管中的溶液越多。
②查阅资料:
a.NO2与水反应的实际过程为:2NO2+H2O=HNO3+HNO2 3HNO2 =HNO3+2NO+H2O;
b.HNO2不稳定。
则产生上述现象的原因是 。


某小组对Cu与浓HNO3的反应进行研究。记录如下:
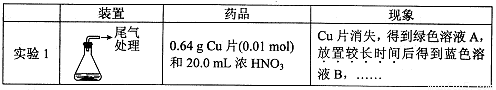
I.Cu与浓HN03反应的化学方程式是 。
II.探究实验1中溶液A呈绿色而不是蓝色的原因。
(1)甲认为溶液呈绿色是由Cu2+离子浓度较大引起的。乙根据实验记录,认为此观点不正确,乙的依据是 。
(2)乙认为溶液呈绿色是由溶解的NO2引起的。进行实验2:先将NO2通入B中,再鼓入N2。结果证实假设成立。则以上两步操作对应的现象分别是 、 。
(3)为深入研究,丙查阅资料,有如下信息:
i.溶有NO2的、浓HNO3呈黄色;水或稀HNO3中通少量NO2溶液呈无色。
ii.NO2溶于水,会发生反应2NO2+H2O =HNO3+HNO2HNO2是弱酸,只能稳定存在于冷、稀的溶液中,否则易分解。
iii.NO—2能与Cu2+反应:Cu2+(蓝色)+4 NO2-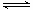 Cu(NO2)42-(绿色)
Cu(NO2)42-(绿色)
据此,丙进一步假设:
①可能是A中剩余的浓HNO3溶解了NO2得到的黄色溶液与Cu(NO3)2的蓝色溶液混合而形成的绿色;
②可能是A中生成了Cu(NO2)2—4使溶液呈绿色。
丙进行如下实验:

①亚硝酸分解的化学方程式是 。
②请用平衡原理解释加入稀H2SO4后绿色溶液变蓝的原因: 。
(4)根据实验得出结论:实验l中溶液A呈绿色的主要原因是 ,请依据实验现象阐述理由: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com