
题目列表(包括答案和解析)
下列各组离子在指定条件下,一定能大量共存的是
A.在 的溶液中:NH4+、Ca2+、Cl-、K+
的溶液中:NH4+、Ca2+、Cl-、K+
B.能溶解Al(OH)3固体的溶液:Na+、K+、Cl-、HCO3-
C. pH=1的无色溶液: Fe3+、K+、SO42-、NO3-
D.FeCl3溶液中加入过量Cu粉充分反应后的溶液:Cl-、Cu2+、Fe2+、Fe3+
Ⅰ.电离平衡常数(用K表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示:
|
化学式 |
HF |
H2CO3 |
HClO |
|
电离平衡常数 (K) |
7.2×10-4 |
K1=4.4×10-7 K2=4.7×10-11 |
3.0×10-8 |
(1)物质的量浓度均为0.1mol/L的下列四种溶液:①Na2CO3溶液 ②NaHCO3溶液 ③NaF溶液 ④NaClO溶液。依据数据判断pH由大到小的顺序是______________。
(2)25℃时,在20mL0.1mol·L—1氢氟酸中加入VmL0.1mol·L—1NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是_______。
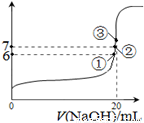
A.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中,c(F-)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(F-)=c(Na+)
D.③点时V=20mL,此时溶液中c(F-)<c(Na+)=0.1mol·L—1
(3)已知25℃时,①HF(aq)+OH-(aq)=F-(aq)+H2O(l) ΔH=-akJ·mol—1,
②H+(aq)+OH-(aq)=H2O(l) ΔH=-bkJ·mol—1,
氢氟酸的电离方程式及热效应可表示为________________________。
(4)长期以来,一直认为氟的含氧酸不存在。1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H—O—F。HFO与等物质的量的H2O反应得到HF和化合物A,则每生成1molHF转移_______mol电子。
Ⅱ.氯化硫酰(SO2Cl2)主要用作氯化剂。它是一种无色液体,熔点–54.1℃,沸点69.1℃。氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:
SO2(g)+Cl2(g) SO2Cl2(l) △H=–97.3kJ·mol—1
SO2Cl2(l) △H=–97.3kJ·mol—1
(1)试写出常温常压下化学平衡常数K的表达式:K=_________________;
(2)对上述反应,若要使化学平衡常数K增大,化学反应速率v正也增大,可采取的措施是_____(选填编号)。
a.降低温度 b.移走SO2Cl2
c.增加反应物浓度 d.无法满足上述条件
(3)下列描述中能说明上述反应已达平衡的是____________(选填编号)。
a.υ(Cl 2)=υ(SO2) b.容器中气体压强不随时间而变化
c.c(Cl 2) : c(SO2)=1:1 d.容器中气体颜色不随时间两变化
(4)300℃时,体积为1L的密闭容器中充入16.20g SO2Cl2,达到平衡时容器中含SO2 7.616g。若在上述中的平衡体系中,再加入16.20g SO2Cl2,当再次达平衡时,容器中含SO2的质量范围是________________________。
下列各组离子在指定条件下,一定能大量共存的是
A.pH=1的无色溶液:Na+、Cu2+、NO3-、SO42-
B.能使碘化钾淀粉试纸变蓝的溶液:K+、Fe2+、SO42-、Cl-
C.水电离出的c(H+)=10-12mol/L的溶液:Ba2+、Na+、Cl-、NO3-
D.能溶解Al(OH)3固体的溶液:K+、Na+、HCO3-、NO3-
下列各组离子在指定条件下,一定能大量共存的是
A.在 的溶液中:NH4+、Ca2+、C1-、K+
的溶液中:NH4+、Ca2+、C1-、K+
B.能溶解Al(OH)3固体的溶液:Na+、K+、Cl-、HCO3-
C. pH=1的无色溶液: Fe3+、K+、SO42-、NO3—
D.FeCl3溶液中加入过量Cu粉充分反应后的溶液:Cl-、Cu2+、Fe2+、Fe3+
(8分)根据信息完成下列方程式。
(1) 化工厂为了检验输送氯气的管道是否漏气,用蘸有浓氨水的粗玻璃棒接近管道,根据是否有白烟产生来判断。用方程式表示其原理。
。
(2) FeSO4溶液在pH=2的硫酸溶液中,暴露在空气中是比较稳定的。如在该溶液中加入氧化亚铁硫杆菌后,大部分Fe2+离子可迅速转化成Fe3+(Fe3+是浸出硫化矿物的良好的出剂)。这一反应是细菌浸出矿物的重要反应之一,该反应方程式为:
。
(3) 四氢硼酸钠(NaBH4)是一种重要的广谱还原剂,写出它在碱性溶液中将Ru3+离子还原为金属的反应的离子方程式。
。
(4) 向KI和H2SO4的混合溶液中加入过氧化氢,放出大量不溶于水的无色气体,同时溶液呈棕黄色,可使淀粉变蓝。
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com