
题目列表(包括答案和解析)
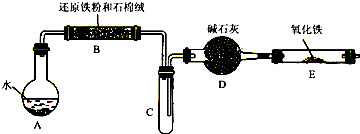
某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)?

(1)装置B中发生反应的化学方程式是________。
(2)装置E中的现象是________________。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法:________________________。
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:?
![]()
![]()
①步骤Ⅰ中通入Cl2的作用是________________________。?
②步骤Ⅱ从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:________________。?
③该流程中需保持盐酸过量,主要原因是(结合离子方程式简要说明)________________________。?
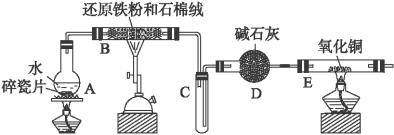
(1)装置B中发生反应的化学方程式是_________________________________________。
(2)装置E中的现象是_________________________________________________。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法:_______________________________________________。
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
滤液![]() FeCl3溶液
FeCl3溶液![]() FeCl3·6H2O晶体
FeCl3·6H2O晶体
①步骤Ⅰ中通入Cl2的作用是____________________________________________。
②步骤Ⅱ从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:___________________________________________________________。
③该流程中需保持盐酸过量,主要原因是(结合离子方程式简要说明)______________________________________________________。
28.某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取
FeCl3·6H2O晶体。(图中夹持及尾气处理装置均己略去)

(1)装置B中发生反应的化学方程式是___________________________。
(2)装置B中的现象是________________________________________。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法:________________________。
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
滤液![]() FeCl3溶液
FeCl3溶液![]() FeCl3·6H2O晶体
FeCl3·6H2O晶体
①步骤Ⅰ中通入Cl2的作用是____________________________________。
②步骤Ⅱ从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:
_____________________________________________________________。
③该流程中需保持盐酸过量,主要原因是(结合离子方程式简要说明)
_____________________________________________________________。
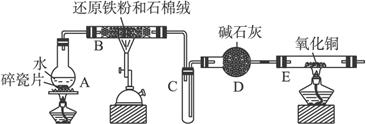
(1)装置B中发生反应的化学方程式是__________________________________________。
(2)装置E中的现象是________________________________________________________。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法:_____________________________________________________。
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
![]()
①步骤Ⅰ中通入Cl2的作用是____________________________________________________。
②步骤Ⅱ从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:___________________
________________________________________________。
③该流程中需保持盐酸过量,主要原因是(结合离子方程式简要说明)___________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com