由于温室效应和资源短缺等问题,如何降低大气中的CO
2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO
2生产燃料甲醇.一定条件下发生反应:CO
2(g)+3H
2(g)?CH
3OH(g)+H
2O(g),图1表示该反应进行过程中能量的变化.
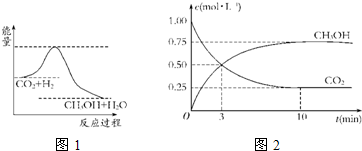
(1)关于该反应的下列说法中,正确的是
C
C
.
A.△H>0,△S>0; B.△H>0,△S<0;
C.△H<0,△S<0; D.△H<0,△S>0.
(2)该图中能量的最高点和最低点之间的差值代表
逆反应的活化能
逆反应的活化能
(3)为探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO
2和3mol H
2,测得CO
2和CH
3OH(g)的浓度随时间变化如图2所示.从反应开始到平衡用氢气浓度变化表示的平均反应速率v(H
2)
0.225
0.225
mol?L
-1?min
-1.
(4)肼(N
2H
4)是一种可燃性的液体,可用作火箭燃料.已知在101kPa时,32.0gN
2H
4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N
2H
4完全燃烧反应的热化学方程式是:
N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol
N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol
.