
题目列表(包括答案和解析)
 红磷 P(s)和 Cl2(g)发生反应生成 PCl3(g)和 PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成 1 mol 产物的数据).
红磷 P(s)和 Cl2(g)发生反应生成 PCl3(g)和 PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成 1 mol 产物的数据).| 3 |
| 2 |
| 3 |
| 2 |
先把干燥氯气贮存在100 mL的注射器内,再把火柴头大小的红磷置于玻璃燃烧匙上烘干后组成如图装置。
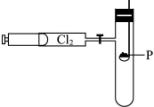
操作分两步进行。首先打开弹簧夹,缓慢推动注射器的针塞,待磷燃烧出现白雾时,立即关闭弹簧夹,停止推入Cl2,片刻后,可见到试管内白雾凝成无色液滴附在试管内壁。然后再打开弹簧夹,继续推入Cl2,就可看到管壁上液滴逐渐消失,管内出现白烟。最后白烟凝结成白色固体附着在试管内壁上。
试完成下列问题:
(1)该实验选择玻璃燃烧匙,不选其他金属燃烧匙的原因是_______________________。
(2)该实验的关键是使用的氯气和红磷必须干燥,其原因是_______________________。
(3)第二次通入氯气时发生反应的化学方程式是_________________________________,推入Cl2之所以要缓慢进行的原因是_________________________________。
已知反应PCl5(g)![]() PCl3(g)+Cl2(g)在230℃达到平衡,平衡混合物中各物质的浓度分别是c(PCl5)=0.47 mol/L,c(PCl3)=0.098 mol/L,c(Cl2)=0.098 mol/L,则这个反应在230℃时的平衡常数为________.
PCl3(g)+Cl2(g)在230℃达到平衡,平衡混合物中各物质的浓度分别是c(PCl5)=0.47 mol/L,c(PCl3)=0.098 mol/L,c(Cl2)=0.098 mol/L,则这个反应在230℃时的平衡常数为________.
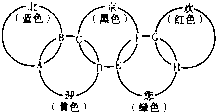 “北、京、欢、迎、您”分别代表五种不同颜色的单质,它们之间相互交叉形成了如图所示的奥运五环旗,A、B、C、D、E、F、G、H是由相交叉的两环元素组成的化合物.
“北、京、欢、迎、您”分别代表五种不同颜色的单质,它们之间相互交叉形成了如图所示的奥运五环旗,A、B、C、D、E、F、G、H是由相交叉的两环元素组成的化合物.| 3 |
| 2 |
| 5 |
| 2 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com