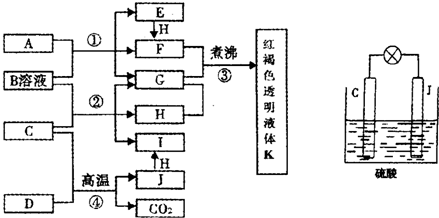
已知D、H是常见的非金属单质,其中H是黄绿色气体.J是一种金属单质,J元素的+2价化合物比+4价化合物稳定.D、J元素在周期表中同主族,D是形成化合物种类最多的元素.A、C是金属氧化物,C和J均是某种常见电池的电极材料,B与C反应时,每生成1mol H同时消耗4mol B和1mol C.它们之间的关系如图:
(1)写出物质A的化学式
Fe3O4
Fe3O4
.
(2)写出反应②的化学方程式
PbO2+4HCl=PbCl2+Cl2↑+2H2O
PbO2+4HCl=PbCl2+Cl2↑+2H2O
.
(3)由金属氧化物A和C得到其相应的金属单质,在冶金工业上一般可用
②
②
方法(填序号).
①热分解法 ②热还原法 ③电解法
其中从A得到其相应金属也可以用铝热法,若反应中lmolA参加反应,转移电子的物质的量为
8
8
mol.
(4)用C、J作电极,与硫酸构成如图所示电池,工作时电池发生的总反应式为
Pb+PbO2+2H2SO4=2PbSO4+2H2O
Pb+PbO2+2H2SO4=2PbSO4+2H2O
,当反应转移1mol电子时,溶液中消耗H
+的物质的量为
2
2
mol.
(5)向框图中的红褐色透明液体K中逐滴滴入HCl溶液.可以观察到先产生红褐色沉淀,后红褐色沉淀溶解,请解释原因
开始加盐酸时,氢氧化铁胶体遇电解质发生聚沉,再继续滴加则氢氧化铁沉淀与盐酸发生酸碱中和反应,沉淀溶解
开始加盐酸时,氢氧化铁胶体遇电解质发生聚沉,再继续滴加则氢氧化铁沉淀与盐酸发生酸碱中和反应,沉淀溶解


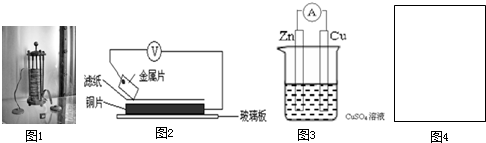
 ”代表反应容器,“
”代表反应容器,“ ”代表导线,“
”代表导线,“ ”代表电极,“
”代表电极,“ ”代表小灯泡,在右侧方框(图4)内画出装置图并指出电极材料和电解质溶液,标出电源的正负极.
”代表小灯泡,在右侧方框(图4)内画出装置图并指出电极材料和电解质溶液,标出电源的正负极.