
题目列表(包括答案和解析)
| 催化剂 |
| 加热 |
| C7(N2)C12(H2O) |
| C6(NO2)C8(NH3) |
| C7(N2)C12(H2O) |
| C6(NO2)C8(NH3) |
| 反应时间/min | n(CO)/mol | H2O/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| 0.2 |
| t1 |
| 0.2 |
| t1 |
| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水样品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
| A、用10mL量筒量取7.13mL稀盐酸 | B、用润湿的pH试纸测盐酸的酸度 | C、用托盘天平称量25.20g NaCl | D、用pH计测得某烧碱溶液的pH为13.15 |
(1)邻苯二甲酸氢钾(相对分子质量为204.2)可以用于标定NaOH溶液的浓度,反应如下:KHC8H4O4+NaOH===KNaC8H4O4+H2O
准确称取0.5105 g KHC8H4O4晶体,溶于水后加入酚酞指示剂,用NaOH溶液滴定溶液由无色变为浅红色,消耗20.00 mL NaOH。计算NaOH溶液的浓度为________(结果保留四位有效数字)。
(2)测定食醋的总酸度。食酸中除醋酸(CH3COOH)外,还含有少量其他有机酸。食醋的总酸度以每1000 mL食醋中含醋酸(其他酸也折算作醋酸)的质量(g)表示,通常写作w(CH3COOH)。用移液管移取50.00 mL市售食醋,置于250 mL容量瓶中,用水稀释至刻度。再从中量取25.00 mL,用(1)小题已知浓度的NaOH溶液滴定,消耗碱液的体积为V(mL),请写出w(CH3COOH)的计算式____________________________________________________。
(3)已知0.1 mol·L-1邻苯二甲酸溶液的pH大于1,取等体积的邻苯二甲酸溶液和某KOH溶液混合,测得混合溶液的pH等于7,则碱与酸的浓度比值x为________(选填下列选项编号)。
A.x>2 B.x=2
C.2>x>1 D.x=1
E.1>x>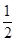 F.x=
F.x=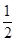
 7N2(g)+12H2O(g)也可处理NO2.则化学平衡常数表达式K=______;当转移1.2mol电子时,消耗的NO2在标准状况下是______L.
7N2(g)+12H2O(g)也可处理NO2.则化学平衡常数表达式K=______;当转移1.2mol电子时,消耗的NO2在标准状况下是______L.| 反应时间/min | n(CO)/mol | H2O/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水样品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
 7N2(g)+12H2O(g)也可处理NO2。则化学平衡常数表达式K=______;当转移1.2mol电子时,消耗的NO2在标准状况下是_______L。
7N2(g)+12H2O(g)也可处理NO2。则化学平衡常数表达式K=______;当转移1.2mol电子时,消耗的NO2在标准状况下是_______L。 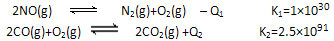
 CO2+H2(g) 反应过程中测定的部分数据见下表(表中t1>t2)
CO2+H2(g) 反应过程中测定的部分数据见下表(表中t1>t2) 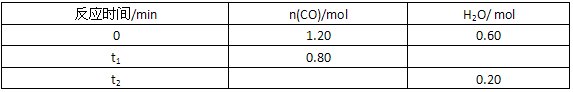

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com