
题目列表(包括答案和解析)
(1)其原子半径大小关系是:D>E>B>C>A;
(2)A、D同主族并可形成离子晶体DA;
(3)B、D、E三者的最高价氧化物对应的水化物两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素;
(4)B、E两种元素原子的最外层电子数之和等于A、C、D三种元素原子的最外层电子数之和。 请填写下列空白:
①B、E两者的最高价氧化物对应的水化物反应后所得产物的溶液的pH________7(填“>”“<”或“=”);
②D
③1 mol E单质与足量的D的最高价氧化物的水化物溶液反应,能产生______mol A2气体,并写出其反应的离子方程式________________;
④BA3与BC在加热和有催化剂存在的条件下能发生反应,生成两种无毒物质,其反应的化学方程式为_______________。
(1)A、B、C、D四种元素组成的化合物中既能与盐酸反应,又能与NaOH反应的相对分子质量最小的化合物的结构简式为? ?,A、B、D、E四种元素组成的化合物中原子个数最少的化合物的化学式? ?,其水溶液的pH? ?7(填“>”“<”或“=”)。
(2)将ACD3的稀溶液和CA3的水溶液混合,不可能出现的结果是(填字母)? ?。?
a.pH<7,且c(H+)>c(CD-3)>c(OH-)>c(CA+4)?
b.pH<7,且c(CD-3)>c(OH-)=c(H+)>c(CA+4)
c.pH>7,且c(CA+4)>c(OH-)>c(CD-3)>c(H+)?
d.pH=7,且c(CA+4)>c(CD-3)>c(H+)>c(OH- )?
(3)A、D、E与氯四种元素中的三种组成化合物X、Y,组成元素原子个数比为1∶1∶1,其水溶液的酸碱性与CA3水溶液的相同;常温下0.1 mol·L-1?的X溶液的pH与0.1 mol·L-1?盐酸的pH之和为14;则X、Y的化学式为X ,Y 。?
(4)常温下,0.01 mol·L-1X的溶液中,水电离产生的OH-的物质的量浓度为? ? mol·L-1;相同pH的X、Y溶液,加水稀释相同倍数后,溶液的pH分别为a1、a2,则a1 a2(填“>”“<”或“=”)。?
(5)“神舟”六号发射时所用火箭推进器中盛有液态的C2A4和液态A2D2,当它们混合时,即产生大量的N2和水蒸气,并放出大量的热。已知0.4 mo1 C2A4与一定量液态A2D2发生上述反应,可放出256.6 kJ的热量,则上述反应的热化学方程式为 。?
(1)D在周期表中位于第_____________周期第_____________族。
(2)B、C、E三种元素原子半径由大到小的顺序是(用相应的元素符号表示)_____________。
(3)由D、E两种元素形成的固体属于_____________晶体(填晶体类型名称)。
(4)写出含D质量分数最高的氢化物的电子式_____________。
(5)A、C、D以原子个数比4∶2∶3形成的化合物,其水溶液的pH_____________7(填“>”“<”或“=”),原因是_____________(用离子方程式表示)。
(1)D在周期表中位于第___________周期第_________族。
(2)B、C、E三种元素原子半径由大到小的顺序是(用相应的元素符号表示)____________。
(3)由D、E两种元素形成的固体属于________________________晶体(填晶体类型名称)。
(4)写出含D质量分数最高的氢化物的电子式____________。
(5)A、C、D以原子个数比4∶2∶3形成的化合物,其水溶液的pH____________7(填“>”“<”或“=”),原因是________________________(用离子方程式表示)。
A、B、C、D、E为短周期元素,其原子序数依次增大。其中,A元素原子半径最小;B元素原子的电子总数与最外层电子数之比为3 :2;C元素最高价氧化物对应水化物与其氢化物反应生成一种盐甲。A、E同主族,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物。请回答:
(1)写出B元素在周期表中的位置 ,C单质的电子式是____________。
(2)A、D、E组成的化合物乙与氯化亚铁溶液反应的实验现象为 。
(3)常温下,甲的水溶液pH_______7(填>、<或=),其原因是(用离子方程式表示)_____________________。
(4)乙和B、D、E组成的化合物丙,它们的水溶液pH均为12时,两溶液中由水电离出的c(OH-),乙 :丙= 。
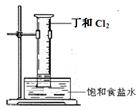
(5)A和B组成化合物丁,其相对分子质量为16。将右图装置放置在光亮的地方(日光没有直接照射),一会儿后,观察到量筒壁上有油状液滴生成等现象。油状液滴的成分可能是(写分子式) 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com