某化学兴趣小组的同学用如图所示实验装置进行研究,请对其方案进行完善或评价.
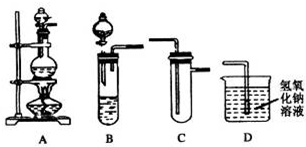
(1)浓硫酸和漂白粉可发生如下反应:
Ca(ClO)
2+CaCl
2+2H
2SO
4═2CaSO
4+2Cl
2↑+2H
2O
实验室用此原理制取并收集氯气,可选用的装置组合是
BCD
BCD
(填写装置序号)
(2)将A、C、D相连,利用实验室常用方法制取并收集氯气.在C中加入适量水,即可制得氯水.将所得氯水分为两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象、结论如下:
实验
序号 |
实验操作 |
现象 |
结论 |
| Ⅰ |
将氯水滴入品红溶液 |
品红溶液褪色 |
氯气与水反应的产物有漂白性 |
| Ⅱ |
氯水中加入碳酸氢钠粉末 |
有无色气体产生 |
氯气与水反应的产物具有酸性 |
判断实验Ⅰ、Ⅱ推出相应结论是否合理;若合理,无需填写理由,若不合理,请说明.
实验Ⅰ:
不合理
不合理
,理由
没有事先证明干燥的氯气无漂白性
没有事先证明干燥的氯气无漂白性
;实验Ⅱ:
不合理
不合理
,理由
新制取的氯气中含HCl气体,溶于水也能与碳酸钠溶液反应产生气体
新制取的氯气中含HCl气体,溶于水也能与碳酸钠溶液反应产生气体
;
(3)将A、C、D相连,可设计实验验证SO
32-还原性强于Cl
-.则C中发生反应的离子方程式是
SO32-+Cl2+H2O═SO42-+2Cl-+2H+
SO32-+Cl2+H2O═SO42-+2Cl-+2H+
;设计实验说明C中确实发生了上述反应(简述实验步骤、现象)
取C中反应后的溶液少许,向其中电极盐酸酸化的氯化钡溶液,有白色沉淀生成
取C中反应后的溶液少许,向其中电极盐酸酸化的氯化钡溶液,有白色沉淀生成
.

