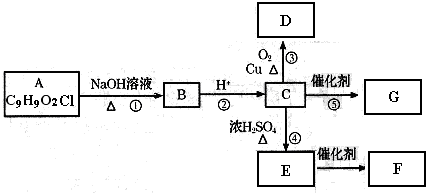
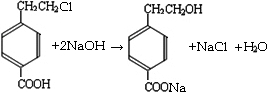
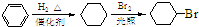(2013?崇明县一模)现有两份铵盐样品A、B,其成分都是(NH
4)
2SO
4、NH
4HSO
4的混合物.甲、乙两个研究性学习小组的同学想要确定A和B中各成分的含量.
甲组同学取了数分相同质量的样品A溶于水,然后分别加入不同体积的1mol/L的NaOH溶液,水浴加热至气体全部逸出.(此温度下,铵盐不分解).该气体干燥后用足量的浓硫酸完全吸收.浓硫酸增重的质量与加入NaOH溶液的体积的关系如右图.分析该图象,并回答下列问题:
(1)写出ab段涉及的离子方程式:
.
(2)c点对应的数值是
4.25
4.25
;样品A中(NH
4)
2SO
4、NH
4HSO
4的物质的量之比为
9:2
9:2
.
乙组同学取了数份不同质量的样品B,分别加入到200mL 1mol/L的NaOH溶液中,同样用水浴加热,将逸出气体干燥后再用浓H
2SO
4吸收.测定结果如下表:
| 实验编号 |
Ⅰ |
Ⅱ |
Ⅲ |
Ⅳ |
| 铵盐的质量(g) |
9.88 |
19.76 |
29.64 |
49.40 |
| 浓硫酸增加的质量(g) |
m |
m |
1.36 |
0 |
分析该表,并回答下列问题:
(3)①分析实验数据可知,实验编号为
I
I
的实验中,氢氧化钠足量,铵盐中的铵根离子完全转化成气体;m的值为
2.04
2.04
.
②计算样品B中氮元素的质量分数.(用小数表示,保留两位小数)
(4)乙组同学在研究时发现,浓硫酸增重的质量与样品B的质量之间满足一定的函数关系.假设样品的质量为x(g),浓硫酸增重的质量为y(g).求:当x在不同范围时y与x的函数关系.





 (2013?崇明县一模)现有两份铵盐样品A、B,其成分都是(NH4)2SO4、NH4HSO4的混合物.甲、乙两个研究性学习小组的同学想要确定A和B中各成分的含量.
(2013?崇明县一模)现有两份铵盐样品A、B,其成分都是(NH4)2SO4、NH4HSO4的混合物.甲、乙两个研究性学习小组的同学想要确定A和B中各成分的含量.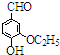 )是食品添加剂的增香原料,其香味比香草醛更加浓郁.
)是食品添加剂的增香原料,其香味比香草醛更加浓郁.
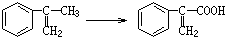
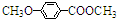 )是一种医药中间体.请设计合理方案用茴香醛(
)是一种医药中间体.请设计合理方案用茴香醛(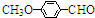 )合成D(其他原料自选,用反应流程图表示,并注明必要的反应条件)
)合成D(其他原料自选,用反应流程图表示,并注明必要的反应条件)